题目内容
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
分析 甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,则甲、乙都有2个电子层,甲元素原子的最外层电子数是2×2=4,故甲为C元素,乙元素原子的最外层电子数为2×3=6,故乙为O元素,丙元素原子K层和M层电子数之和与L层的电子数相同,则M层电子数为8-2=6,故丙为S元素,据此解答.
解答 解:甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,则甲、乙都有2个电子层,甲元素原子的最外层电子数是2×2=4,故甲为C元素,乙元素原子的最外层电子数为2×3=6,故乙为O元素,丙元素原子K层和M层电子数之和与L层的电子数相同,则M层电子数为8-2=6,故丙为S元素.
A.非金属性C<S<O,元素的非金属性越强,氢化物的稳定性越强,所以三者氢化物的稳定新的顺序是乙>丙>甲,故A错误;
B.甲的最高价氧化物对应的水化物是碳酸,丙的最高价氧化物对应的水化物是硫酸,而硫酸的酸性强于碳酸的酸性,故B正确.
C.同周期自左而右原子半径减小,原子半径的大小甲(C)>乙(O),故C正确;
D.乙元素是ⅥA元素,甲元素是ⅣA元素,故D正确.
故选:A.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期律,题目难度不大,注意把握核外电子排布规律与元素周期表的结构.

练习册系列答案
相关题目
10.下列说法错误的是( )
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1 mol醋酸分子中含有共价键的个数为8NA |
7.氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.

(1)反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
则表中X的值是391.
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是加入催化剂.

(1)反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | X | 946 |
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是加入催化剂.
14.下列有关热化学方程式的叙述正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O,△H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 |
4.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.
(2)J和氢组成10电子的化合物,其分子式为CH4.
(3)M和T的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成10电子的化合物,其分子式为CH4.
(3)M和T的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
11.在一定温度下,将100mL 氮气和氢气的混合气体充入等压密闭容器中进行反应,达平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为( )
| A. | 25% | B. | 27.5% | C. | 30% | D. | 37.5% |
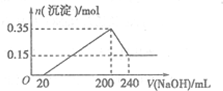 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.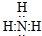 ;过氧化钠
;过氧化钠 .
.
 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′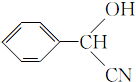 ;
; ;
;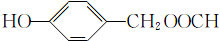 (填结构简式).
(填结构简式).