题目内容
4.M是一种重要的医药中间体,其合成路线如图:
已知:
RCHO$→_{②NaCN}^{①NaHSO_{3}}$
 ;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′
;RCN$\stackrel{H_{2}O/H+}{→}$RCOOH;RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R'OH}{→}$RCOOR′回答下列问题:
(1)A的名称是甲苯,F中所含官能团的名称是羟基、羧基;
(2)C→D的反应类型为氧化反应,H→I的反应类型为取代反应;
(3)E的结构简式为
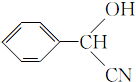 ;
;(4)F+I→M的化学方程式为
 ;
;(5)F的同分异构体中,符合下列条件的共有9种.
①能与FeCl3溶液发生显色反应
②能发生水解反应
③苯环上只有两个取代基
其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是
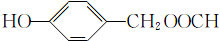 (填结构简式).
(填结构简式).
分析 根据流程图,A中应该含有苯环,A为 ,在光照时侧链与氯气发生取代反应,则B为
,在光照时侧链与氯气发生取代反应,则B为 ,B在氢氧化钠溶液中水解生成C,则C为
,B在氢氧化钠溶液中水解生成C,则C为 ,C氧化生成D为
,C氧化生成D为 ;根据已知信息,E为
;根据已知信息,E为 ,F为
,F为 ,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M(
,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M( ).
).
解答 解:根据流程图,A中应该含有苯环,A为 ,在光照时侧链与氯气发生取代反应,则B为
,在光照时侧链与氯气发生取代反应,则B为 ,B在氢氧化钠溶液中水解生成C,则C为
,B在氢氧化钠溶液中水解生成C,则C为 ,C氧化生成D为
,C氧化生成D为 ;根据已知信息,E为
;根据已知信息,E为 ,F为
,F为 ,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M(
,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M( ).
).
(1)根据上述分析,A为甲苯,F为 ,所含官能团是羟基和羧基,
,所含官能团是羟基和羧基,
故答案为:甲苯;羟基、羧基;
(2)C为苯甲醇,C氧化生成D(苯甲醛);H为乙酸(CH3COOH),根据信息知,H与二氯亚砜发生取代反应生成I(CH3COCl),
故答案为:氧化反应;取代反应;
(3)根据上述分析,E为 ,故答案为:
,故答案为: ;
;
(4)根据信息,F和I在一定条件下发生取代反应生成M,反应的化学方程式为 ,
,
故答案为: ;
;
(5)F为 ,其同分异构体满足:①能与FeCl3溶液发生显色反应,表明分子结构中存在酚羟基;②能发生水解反应,表明分子结构中含有酯基;③苯环上只有两个取代基,符合上述条件的F的同分异构体的结构简式有:
,其同分异构体满足:①能与FeCl3溶液发生显色反应,表明分子结构中存在酚羟基;②能发生水解反应,表明分子结构中含有酯基;③苯环上只有两个取代基,符合上述条件的F的同分异构体的结构简式有: (包括邻位、间位和对位3种);
(包括邻位、间位和对位3种); (包括邻位、间位和对位3种);
(包括邻位、间位和对位3种); (包括邻位、间位和对位3种),共9种,其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是
(包括邻位、间位和对位3种),共9种,其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是 ,
,
故答案为:9; .
.
点评 本题考查了有机合成与推断,充分利用有机物分子式、反应条件及给予的信息进行分析,熟练掌握官能团的性质与转化,较好的考查学生信息获取与知识迁移运用.

| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
| A. | 6和8 | B. | 11和8 | C. | 20和8 | D. | 20和17 |
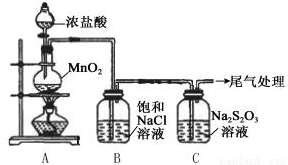
实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)将C中雾通入品红溶液检验是否有SO2,该操作不合理的理由是C中雾有氯气.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是.乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.在图中的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )| A. | Cu与稀盐酸 | B. | NH4HCO3与稀盐酸 | ||
| C. | CaCO3与稀硫酸 | D. | NaHCO3与NaOH溶液 |
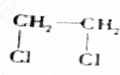 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;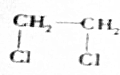 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;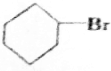 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$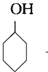 +NaBr;
+NaBr;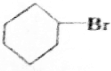 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$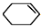 +H2O+NaBr.
+H2O+NaBr.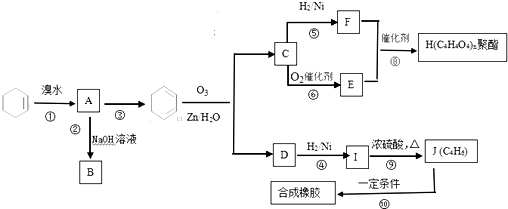
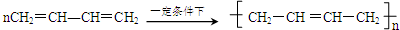 .
.

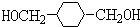 .
.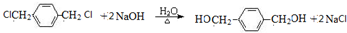 .
. .
. .
.