题目内容
10.下列说法错误的是( )| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1 mol醋酸分子中含有共价键的个数为8NA |
分析 A.酸溶液中存在离子积常数,0.1 mol•L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L;
B.pH=2醋酸溶液中氢离子浓度为10-2mol/L,pH=1的溶液中氢离子浓度为10-1mol/L;
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,醋酸是弱电解质存在大量平衡,反应后又电离出氢离子溶液显酸性;
D.1个醋酸分子CH3COOH中含有共价键的个数为8个;
解答 解:A.酸溶液中存在离子积常数,0.1 mol•L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L,由水电离的c(H+)大于10-13 mol•L-1,故A错误;
B.pH=2醋酸溶液中氢离子浓度为10-2mol/L,pH=1的溶液中氢离子浓度为10-1mol/L,pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10,故B正确;
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,醋酸是弱电解质存在大量平衡,反应后又电离出氢离子溶液显酸性,pH<7,故C正确;
D.1个醋酸分子CH3COOH中含有共价键的个数为8个,1 mol醋酸分子中含有共价键的个数为8NA,故D正确;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较,酸碱反应后溶液酸碱性的判断,注意弱电解质的电离平衡,题目难度中等.

练习册系列答案
相关题目
1.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
18.下列离子方程式正确的是( )
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
15.下列现象中,不能用“相似相溶”原理解释的是( )
| A. | 酒精与水以任意比互溶 | B. | 用纯碱洗涤油脂 | ||
| C. | 氨易溶于水 | D. | 用苯将溴水中的溴萃取出来 |
2.下列排序正确的是( )
| A. | 沸点:CH4>NH3 | B. | 原子半径:Na>Mg | C. | 热稳定性:H2S>HF | D. | 还原性:I?<Br? |
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
20.A和B两元素能形成AB2型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和8 | C. | 20和8 | D. | 20和17 |
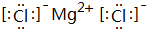 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.