题目内容
9.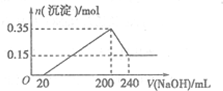 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.(1)加入NaOH20~200mL时发生反应离子方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;加入NaOH200~240mL时发生反应离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)镁和铝的总质量为9g.
(3)硫酸的物质的量浓度为2.5 mol/L.
(4)生成的氢气在标准状况下的体积为10.08L.
分析 (1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此过程中镁离子、铝离子与氢氧根离子反应生成Mg(OH)2和Al(OH)3;从200mL到240mL,NaOH溶解Al(OH)3,据此写出反应的离子方程式;
(2)根据沉淀的最大量可知氢氧化镁和氢氧化铝的总物质的量、最小量,最小量为氢氧化镁,根据最大量可知氢氧化铝的物质的量,然后利用质量守恒计算出镁、铝的物质的量,再根据m=nM计算出混合金属的质量;
(3)溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍,据此计算硫酸的物质的量,进而计算浓度大小;
(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,又硫酸过量所以镁铝全部反应,根据得失电子守恒进行计算.
解答 解:(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,离子方程式为:OH-+H+=H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,发生反应为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;从200mL到240mL,NaOH溶解Al(OH)3,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)根据天下可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,
由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,
所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,
故答案为:9;
(3)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×0.2L×5mol/L=0.5mol,所以硫酸的浓度为$\frac{0.5mol}{0.2L}$=2.5mol/L,
故答案为:2.5;
(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,根据得失电子守恒氢气在标准状况下的体积为:$\frac{0.15×2+0.2×3}{2}$×22.4L=10.08L,
故答案:10.08.
点评 本题考查镁铝的重要化合物及计算,题目难度中等,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查.

 计算高手系列答案
计算高手系列答案 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |

| A. | 锌片发生还原反应 | |
| B. | 该装置将电能转化为化学能 | |
| C. | 电子由铁电极经导线流向锌电极 | |
| D. | 如果将锌片换成铜片,电路中的电流方向将会改变 |
| A. | 非金属性比硫强 | B. | 阴离子比Br-半径小 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
| A. | 与浓硫酸共热发生消去反应 | B. | 与浓氢溴酸发生卤代反应 | ||
| C. | 与氧气、铜发生催化氧化反应 | D. | 与草酸发生酯化反应 |
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
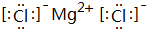 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.