题目内容
4.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成10电子的化合物,其分子式为CH4.
(3)M和T的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
分析 J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素;M是地壳中含量最多的金属元素,故M为Al元素,而T的原子序数大于S,且为短周期主族元素,故T为Cl元素,据此进行解答.
解答 解:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素;M是地壳中含量最多的金属元素,故M为Al元素,而T的原子序数大于S,且为短周期主族元素,故T为Cl元素,
(1)M的离子为Al3+,其结构示意图为: ;元素T为Cl元素,氯元素在周期表中位于第ⅦA族,
;元素T为Cl元素,氯元素在周期表中位于第ⅦA族,
故答案为: ;ⅦA;
;ⅦA;
(2)J为C元素,J和氢组成10电子的化合物为甲烷,分子式为:CH4,
故答案为:CH4;
(3)M的最高价氧化物对应的水化物是氢氧化铝,氯的最高价氧化物对应的水化物是HClO4,两者反应的化学方程式为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
点评 本题考查原子结构与元素周期律的综合应用,为高频考点,题目难度中等,通过“地壳中含量最多的金属元素”等类似的条件判断元素的类别为解答结构,注意掌握原子结构与性质,试题培养了学生的灵活应用能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
14.C5H11(戊醇)发生下列反应时,所得有机产物结构种数最少(不考虑立体异构)的是( )
| A. | 与浓硫酸共热发生消去反应 | B. | 与浓氢溴酸发生卤代反应 | ||
| C. | 与氧气、铜发生催化氧化反应 | D. | 与草酸发生酯化反应 |
15.下列现象中,不能用“相似相溶”原理解释的是( )
| A. | 酒精与水以任意比互溶 | B. | 用纯碱洗涤油脂 | ||
| C. | 氨易溶于水 | D. | 用苯将溴水中的溴萃取出来 |
12.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
9.某天然蛋白质充分水解后,能分离出有机物R,R可与等物质的量的KOH或HCl(由盐酸提供)完全反应,4.45gR可与50mL1mol•L-1的Na0H完全中和,则R的结构简式为( )
| A. | 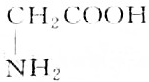 | B. | 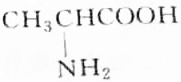 | ||
| C. | 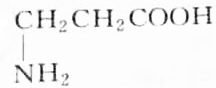 | D. | 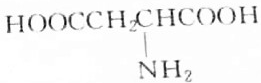 |
16.下列结构示意图中,表示的是阴离子且电荷最多的是( )
| A. | 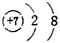 | B. | 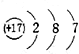 | C. | 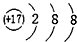 | D. | 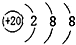 |


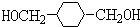 .
.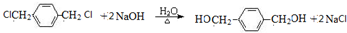 .
. .
.