题目内容
7.氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.
(1)反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | X | 946 |
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是加入催化剂.
分析 (1)从图象可知,反应物能量高于生成物,反应放热,△H=生成物能量和-反应物能量和;
(2)据△H=反应物键能和-生成物键能和求算;
(3)反应的活化能降低了,催化剂能够降低反应的活化能;
解答 解:(1)从图象可知,△H=生成物能量和-反应物能量和=-92KJ/mol,故答案为:-92;
(2)△H=反应物键能和-生成物键能和,-92KJ/mol=3×436KJ/mol+946KJ/mol-6×X(N-H),所以X(N-H)=391KJ/mol,
故答案为:391;
(3)实线I比虚线II的活化能高,其他相同,说明使用了催化剂,因为催化剂是通过降低反应的活化能加快反应速率的,故答案为:加入催化剂;
点评 本题考查了焓变的两种求算方法、催化剂对反应的影响、可逆反应的反应热计算等知识,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.某原电池装置示意图如图所示.下列关于该原电池的说法正确的是( )


| A. | 锌片发生还原反应 | |
| B. | 该装置将电能转化为化学能 | |
| C. | 电子由铁电极经导线流向锌电极 | |
| D. | 如果将锌片换成铜片,电路中的电流方向将会改变 |
18.下列离子方程式正确的是( )
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
15.下列现象中,不能用“相似相溶”原理解释的是( )
| A. | 酒精与水以任意比互溶 | B. | 用纯碱洗涤油脂 | ||
| C. | 氨易溶于水 | D. | 用苯将溴水中的溴萃取出来 |
2.下列排序正确的是( )
| A. | 沸点:CH4>NH3 | B. | 原子半径:Na>Mg | C. | 热稳定性:H2S>HF | D. | 还原性:I?<Br? |
12.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
16.下列结构示意图中,表示的是阴离子且电荷最多的是( )
| A. |  | B. |  | C. |  | D. |  |
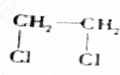 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;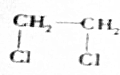 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;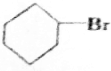 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$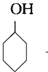 +NaBr;
+NaBr;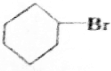 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$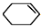 +H2O+NaBr.
+H2O+NaBr.