题目内容
11.在一定温度下,将100mL 氮气和氢气的混合气体充入等压密闭容器中进行反应,达平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为( )| A. | 25% | B. | 27.5% | C. | 30% | D. | 37.5% |
分析 设原混合气体中氮气的体积为a mL,则氢气的体积为(100-a)mL,令参加反应的氮气为x mL,利用三段式表示出平衡时各物质的体积,混合气体总质量不变,则密度与体积成反比,据此列方程计算x的值,从而求氨气的体积分数,由此分析解答.
解答 解:设原混合气体中氮气的体积为a mL,则氢气的体积为(100-a)mL,令参加反应的氮气为x mL,则:
N2 +3 H2 ?2 NH3
起始(L):a 100-a 0
转化(L):x 3x 2x
平衡(L):a-x 100-a-3x 2x
混合气体总质量不变,则密度与体积成反比,则有:$\frac{100}{100-2x}$=1.25,解得x=10,
混合气体体积减少量等于氨气的体积,所以氨气的体积分数为$\frac{20}{100-20}$×100%=25%,故选A.
点评 本题考查化学平衡有关计算,题目计算量较大,侧重考查学生的分析计算能力,难度较大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
1.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
2.下列排序正确的是( )
| A. | 沸点:CH4>NH3 | B. | 原子半径:Na>Mg | C. | 热稳定性:H2S>HF | D. | 还原性:I?<Br? |
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
16.下列结构示意图中,表示的是阴离子且电荷最多的是( )
| A. | 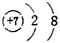 | B. | 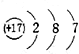 | C. | 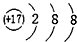 | D. | 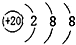 |
3.一定温度下的密度容器中发生:2HI(g)?I2(g)+H2(g),该反应达平衡状态的标志是( )
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
20.A和B两元素能形成AB2型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和8 | C. | 20和8 | D. | 20和17 |
16.Na2S2O3是一种重要的化学试剂,在酸性条件下S2O32-迅速分解为S和SO2,在医疗上运用其还原性和硫的杀菌作用治疗疾病.某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
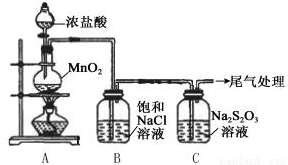
实验操作和现象:
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)将C中雾通入品红溶液检验是否有SO2,该操作不合理的理由是C中雾有氯气.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是.乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.

实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)将C中雾通入品红溶液检验是否有SO2,该操作不合理的理由是C中雾有氯气.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是.乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.