题目内容
8.化学键与化学反应中的能量变化、物质变化密切相关.现有下列七种物质:①氢气②氖气③氨气④金刚石⑤过氧化钠⑥氯水⑦氯化铵.
回答下列问题:
(1)不存在化学键的是②(填序号),氯化铵中的化学键类型有共价键和离子键.
(2)写出下列物质的电子式:氨分子
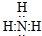 ;过氧化钠
;过氧化钠 .
.(3)石墨转化成金刚石属于化学变化,理由是有新物质金刚石生成.
(4)氢气和氯气反应过程中,断裂1molH2中的化学键消耗的能量为Q1,断裂1molCl2中的化学键消耗的能量为Q2,形成1molHCl中的化学键释放的能量为Q3,则Q1、Q2、Q3的关系为Q1+Q2<2Q3(填“>”、“=”或“<”)
(5)其他平衡类同化学平衡,已知氯水中存在下列平衡Cl2+H2O?HCl+HCl,HClO?H++ClO-,H2O?H++OH-.则氯水中含有的阴离子有ClO-、Cl-、OH-.
分析 (1)根据物质的构成微粒和微粒之间的作用力分析;
(2)氨气中存在3个氮氢键,氮原子最外层8个电子;过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
(3)有新物质生成的变化属于化学变化;
(4)氢气与氯气反应生成HCl,属于放热反应;
(5)根据氯水的组成分析.
解答 解:(1)稀有气体属于单原子分子,分子中没有共价键,所以氖气中没化学键;氯化铵中铵根离子与氯离子之间形成离子键,铵根离子内存在N-H共价键,所以氯化铵中存在离子键和共价键;
故答案为:②;共价键和离子键;
(2)氨气中存在3个氮氢键,氮原子最外层8个电子,氨气的电子式为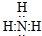 ;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
故答案为: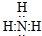 ;
; ;
;
(3)有新物质生成的变化属于化学变化,所以石墨转化成金刚石属于化学变化;
故答案为:化学;有新物质金刚石生成;
(4)氢气和氯气反应过程中,断裂1molH2中的化学键消耗的能量为Q1,断裂1molCl2中的化学键消耗的能量为Q2,形成1molHCl中的化学键释放的能量为Q3,该反应属于放热反应,所以Q1+Q2<2Q3;
故答案为:<;
(5)已知氯水中存在下列平衡Cl2+H2O?HCl+HCl,HClO?H++ClO-,H2O?H++OH-,HCl在溶液中完全电离,HClO在溶液中部分电离,所以溶液中阴离子为:ClO-、Cl-、OH-;
故答案为:ClO-、Cl-、OH-.
点评 本题考查了化学键、电子式、化学变化、以化学反应中的能量变化、氯水的成分等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大,注意相关知识的积累

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
19.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
16.下列结构示意图中,表示的是阴离子且电荷最多的是( )
| A. |  | B. | 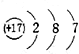 | C. | 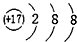 | D. | 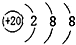 |
3.一定温度下的密度容器中发生:2HI(g)?I2(g)+H2(g),该反应达平衡状态的标志是( )
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
20.A和B两元素能形成AB2型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和8 | C. | 20和8 | D. | 20和17 |
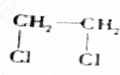 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;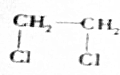 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;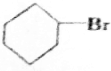 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$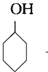 +NaBr;
+NaBr;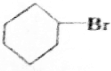 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$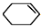 +H2O+NaBr.
+H2O+NaBr.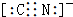 .
.