题目内容
13.区别溶液和胶体最简单的方法( )| A. | 看外观 | B. | 加热 | ||
| C. | 分析粒子直径大于10-7cm | D. | 发生丁达尔现象 |
分析 根据胶体、溶液的性质判断,胶体具有丁达尔效应,而溶液不具备该性质.
解答 解:A、有些溶液和胶体都是均匀的、透明的,无法区别,故A错误;
B、加热胶体能发生聚沉,溶液没有变化,能区分,但不是最简单的方法,故B错误;
C、微粒直径大小需要借助仪器测定,不是最简单的方法,故C错误;
D、溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现光亮光路,为丁达尔现象,所以可以用丁达尔效应区分二者,故D正确;
故选D.
点评 本题考查学生胶体的特性以及溶液和胶体的鉴别知识,是对课本知识的考查,题目较简单.

练习册系列答案
相关题目
3.用NA表示阿伏加德罗常数的值.下列叙述中错误的是( )
| A. | 分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为11.2 L | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 40 g NaOH溶解在1 L水中,所制得的100 mL溶液中含Na+数为0.1 NA |
1.下列是元素周期表的前三周期中的部分元素
(1)表中所标出的元素当中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ne;
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
| 族 周 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
8.下列有关化学用语表示正确的是( )
| A. | 氯乙烯的结构式:H2C=CHCl | B. | S2-的结构示意图: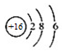 | ||
| C. | 熟石膏的化学式:2CaSO4•H2O | D. | 二氧化碳的比例模型: |
5.根据化学反应的实质是旧键断裂,新键形成这一观点,下列变化不属于化学反应的是( )
| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |
2.下列元素的原子既可以通过离子键,又可以通过共价键形成二元化合物的是( )
| A. | K | B. | Ca | C. | F | D. | Ne |
6.在一固定体积的密闭容器中,充入2mol CO2和1mol H2发生如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO2的浓度增大,则容器内气体温度升高(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是AD(填字母序号).
A.H2的浓度保持不变
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol CO的同时,生成n mol的H2O
D.υ(正、CO)=υ(逆、CO2)
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO2的浓度增大,则容器内气体温度升高(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是AD(填字母序号).
A.H2的浓度保持不变
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol CO的同时,生成n mol的H2O
D.υ(正、CO)=υ(逆、CO2)