题目内容
8.下列有关化学用语表示正确的是( )| A. | 氯乙烯的结构式:H2C=CHCl | B. | S2-的结构示意图: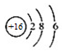 | ||
| C. | 熟石膏的化学式:2CaSO4•H2O | D. | 二氧化碳的比例模型: |
分析 A.氯乙烯的结构式要书写所有化学键,H2C=CHCl是结构简式;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
C.生石膏的组成CaSO4•2H2O,熟石膏化学式2CaSO4•H2O;
D.二氧化碳分子中,碳原子半径大于氧原子.
解答 解:A.H2C=CHCl是结构简式,氯乙烯结构式为 ,故A错误;
,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故B错误;
,故B错误;
C.熟石膏的化学式为2CaSO4•H2O,故C正确;
D.二氧化碳分子中碳原子半径大于氧原子,二氧化碳正确的比例模型为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,注意掌握比例模型、离子结构示意图、结构式等化学用语的概念及书写原则,明确原子结构示意图与离子结构示意图、比例模型与球棍模型、结构简式和结构式的关系.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
18.物质X2CO3的饱和溶液V mL,密度为ρg/cm3,X+的物质的量浓度为c mol/L,溶质的质量分数为a%,溶质的相对分子量为M,溶质的溶解度为s g.则下列表达式正确的是( )
| A. | c=$\frac{1000ρ×a%}{M}$×2 | B. | a=$\frac{cMV}{1000}$ | C. | c=$\frac{CM}{200ρ}$ | D. | V×ρ×a%=$\frac{cMV}{1000}$ |
16.下列说法正确的是( )
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
3.化学已渗透到人类生产生活的各个方面,下列说法合理的是( )
| A. | PM2.5含有的铅、铬、镉、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 绿色化学的核心是利用化学原理减少和消除工业生产对环境的污染 | |
| C. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| D. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 |
13.区别溶液和胶体最简单的方法( )
| A. | 看外观 | B. | 加热 | ||
| C. | 分析粒子直径大于10-7cm | D. | 发生丁达尔现象 |
20.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则C1=l0C2 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | NaHCO3溶液中有:HCO3-+H2O?CO32-+H3O+加水稀释后,H+浓度减小 |
17.下列实验操作和现象及所得出的结论叙述正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| C | 向浓度均为0.1mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
1.由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
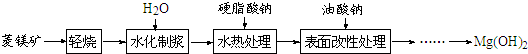
(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
(4)已知热化学方程式:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81.5kJ•mol-1
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.

(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.