题目内容
18.按要求填空:(1)将质量比为7:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为1:2;氮原子和氧原子的个数之比为2:1;22克该混合气体在标准状况下的体积为16.8 L.
(2)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4:3时,则Mg2+与SO物质的量浓度之比为8:5
(3)将8g铁片放入100mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,“铁片”变为8.4g,则原c(CuSO4)为0.5mol/L.
(4)使4.48L CO2气体迅速通过Na2O2固体后得到3.36L(标准状况下)气体,这3.36L气体的质量是6 g.
分析 (1)利用n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算物质的量及其比值,利用构成来计算原子个数比,以此解答;
(2)Cl-与Mg2+的物质的量之比为3:4,则可以分别设出氯化镁和硫酸镁的物质的量,然后判断即可;
(3)发生反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算溶液中硫酸铜的物质的量,进而计算其物质的量浓度;
(4)根据差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断3.36L气体的组成及各成分的体积,再根据n=$\frac{V}{{V}_{m}}$各组分气体的物质的量,再根据m=nM计算各组分质量并求和.
解答 解:(1)由质量比为7:15的N2和NO混合,设混合气体中N2和NO的质量分别为28g、60g,
则N2的物质的量为$\frac{28g}{28g/mol}$=1mol,NO的物质的量为$\frac{60g}{30g/mol}$=2mol,
即混合气体中N2和NO的物质的量之比为1mol:2mol=1:2,
氮原子和氧原子的个数比为(1mol×2+2mol×1mol):2mol=2:1,
该混合气体的平均摩尔质量为$\frac{28g+60g}{1mol+2mol}$=29.3g/mol,22克该混合气体在标准状况下的体积为:$\frac{22g}{29.3g/mol}×22.4L/mol$=16.8L,
故答案为:1:2;2:1;16.8 L;
(2)设氯化镁的物质的量为x,硫酸镁的物质的量为y,依据题意有$\frac{x+y}{2x}=\frac{4}{3}$,解得$\frac{x}{y}$=$\frac{3}{5}$,所以镁离子的物质的量为x+y=$\frac{8x}{3}$,硫酸根的物质的量=y=$\frac{5x}{3}$.两者的比值为8:5,故答案为:8:5;
(3)设原溶液中硫酸铜的物质的量为xmol,则:
Fe+CuSO4═FeSO4+Cu△m
1mol 64g-56g=8g
xmol 8.4g-8g=0.4g
所以1mol:xmol=8g:0.4g
解得x=0.05,
则原溶液中CuSO4的物质的量浓度=$\frac{0.05}{0.1}$=0.5mol/L,故答案为:0.5;
(4)令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=Na2CO3+O2 △V
2 1 1
a b 4.48L-3.36L=1.12L
解得:a=2.24L,b=1.12L,
因生成氧气的体积1.12L,小于3.36L,故二氧化碳有剩余,所以3.36L气体中CO2体积为4.48L-2.24L=2.24L,O2的体积为1.12L,
则3.36L气体的质量为$\frac{2.24L}{22.4L/mol}$×44g/mol+$\frac{1.12L}{22.4L/mol}$×32g/mol=6.0g,故答案为:6.
点评 本题考查物质的量的简单计算,巧设物质的质量可简化计算,并熟悉质量与物质的量的关系及常见物质的摩尔质量即可计算解答.

| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
| A. | 看外观 | B. | 加热 | ||
| C. | 分析粒子直径大于10-7cm | D. | 发生丁达尔现象 |
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
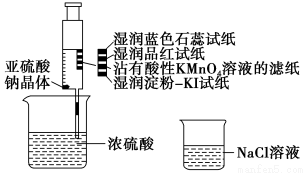
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
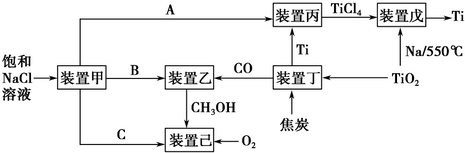
请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2 ↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度.



