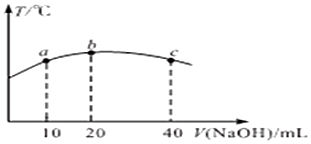
题目内容
5.根据化学反应的实质是旧键断裂,新键形成这一观点,下列变化不属于化学反应的是( )| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |
分析 化学反应的实质是原子的重新组合,即旧化学键的断裂,新化学键的形成过程;
A.干冰气化是物质的三态变化,只是分子间的距离发生了改变;
B.同素异形体的转化是化学变化,分子结构发生了改变;
C.离子化合物NH4HCO3 加热分解生成了氨气、二氧化碳和水;
D.加热碳酸氢钠分解生成碳酸钠、二氧化碳和水.
解答 解:A.干冰气化是物质的三态变化,没有化学键的断裂与形成,只是分子间的距离发生了改变,是物理变化,故A正确;
B.同素异形体的转化是化学变化,分子结构发生了改变,原子重新组合,旧化学键断裂新化学键形成,属于化学变化,故B错误;
C.离子化合物NH4HCO3 加热分解破坏了旧化学键,形成新化学键,是化学变化,故C错误;
D.加热碳酸氢钠分解生成碳酸钠、二氧化碳和水,破坏了旧化学键,形成新化学键,是化学变化,故D错误;
故选A.
点评 本题考查了从化学键的形成与断裂来分析化学反应的实质,重点考查了同素异形体的转化、物质的分解过程、物质的气化过程,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列四种物质:Cu粉、澄清石灰水、Na2CO3溶液、稀硫酸两两混合后,将发生的离子反应有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
16.下列说法正确的是( )
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
13.区别溶液和胶体最简单的方法( )
| A. | 看外观 | B. | 加热 | ||
| C. | 分析粒子直径大于10-7cm | D. | 发生丁达尔现象 |
20.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则C1=l0C2 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | NaHCO3溶液中有:HCO3-+H2O?CO32-+H3O+加水稀释后,H+浓度减小 |
10.已知酸性:H2SO3<H2SO4,某同学在注射器中少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准,如图所示).则下列有关说法正确的是( )
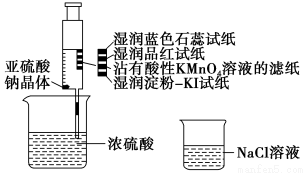

| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
17.下列实验操作和现象及所得出的结论叙述正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| C | 向浓度均为0.1mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |