题目内容
2.下列元素的原子既可以通过离子键,又可以通过共价键形成二元化合物的是( )| A. | K | B. | Ca | C. | F | D. | Ne |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.K是活泼金属元素,易和其它元素形成离子键,不能形成共价键,故A错误;
B.Ca是活泼金属元素,易和其它元素形成离子键,不能形成共价键,故B错误;
C.F元素是较活泼非金属元素,易和活泼金属元素形成离子键,如Na等,易和活泼非金属元素易形成共价键,如氢气等,故C正确;
D.Ne是惰性气体,性质较稳定,不易形成化合物,故D错误;
故选C.
点评 本题考查化学键,为高频考点,明确离子键、共价键形成条件是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]组成可通过下列实验测定:
①称取一定质量的该物质样品,加入足量稀盐酸充分溶解,将所得溶液稀释并配制成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、烘干至恒重,得到白色固体9.32g.
③再量取25.00mL溶液A,加入足量NaOH浓溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成.
④将③所得沉淀过滤、洗涤、灼烧至恒重,最终得固体4.80g.
下列判断正确的是( )
①称取一定质量的该物质样品,加入足量稀盐酸充分溶解,将所得溶液稀释并配制成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、烘干至恒重,得到白色固体9.32g.
③再量取25.00mL溶液A,加入足量NaOH浓溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成.
④将③所得沉淀过滤、洗涤、灼烧至恒重,最终得固体4.80g.
下列判断正确的是( )
| A. | 铂丝蘸取少量A溶液于酒精灯上灼烧,透过钴玻璃,可观察到蓝色火焰 | |
| B. | A溶液中存在c(K+)+c(NH4+)+3 c(Fe3+)=2 c(SO42-)+c(Cl-) | |
| C. | y+z=16 | |
| D. | 若④中沉淀灼烧不充分,将导致z偏小 |
13.区别溶液和胶体最简单的方法( )
| A. | 看外观 | B. | 加热 | ||
| C. | 分析粒子直径大于10-7cm | D. | 发生丁达尔现象 |
10.已知酸性:H2SO3<H2SO4,某同学在注射器中少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准,如图所示).则下列有关说法正确的是( )
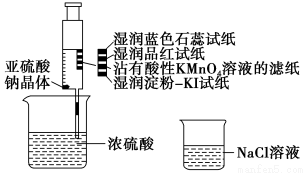

| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
17.下列实验操作和现象及所得出的结论叙述正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| C | 向浓度均为0.1mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
11.可以将四种无色液体:C2H5OH、C2H5Br、苯、KI溶液一一区分开的试剂是( )
| A. | FeCl2溶液 | B. | 溴水 | C. | NaOH溶液 | D. | 水 |
15.下列认识中,正确的是( )
| A. | 将一种气体通入品红溶液,溶液褪色,说明该气体一定是二氧化硫 | |
| B. | K+、NH4+、SO42-、CO32-离子组在加入铝粉能放出大量H2的溶液中一能能大量共存 | |
| C. | FeBr2溶液中通入过量Cl2时的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 在纯碱溶液中逐滴加入稀盐酸时,开始没有气泡产生 |