题目内容
20.关于某溶液中所含物质的鉴别,下列判断正确的是( )| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
分析 A.白色沉淀可能为碳酸钙、氢氧化镁;
B.若白色沉淀为亚硫酸钡,加盐酸,在酸性条件下与硝酸根离子、亚硫酸钡发生氧化还原反应生成硫酸钡;
C.碘溶解在四氯化碳中为紫色;
D.白色沉淀为AgCl或硫酸银.
解答 解:A.白色沉淀可能为碳酸钙、氢氧化镁,则原溶液中可能含镁离子或碳酸根离子,但不能同时存在,故A错误;
B.若白色沉淀为亚硫酸钡,加盐酸,在酸性条件下与硝酸根离子、亚硫酸钡发生氧化还原反应生成硫酸钡,则不能确定是否含SO42-,故B错误;
C.碘溶解在四氯化碳中为紫色,则原溶液中存在碘单质,故C正确;
D.白色沉淀为AgCl或硫酸银,则溶液中可能含Cl-或SO42-,故D错误;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
相关题目
8.下列有关热化学方程式的叙述中,正确的是( )
| A. | 含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1)△H=-114.8kJ/mol | |
| B. | 已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol | |
| D. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.31kJ•mol-1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1 |
15.O3在水中易分解生成O2,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.02mol•L-1.
(1)pH增大能加速(填“加速”或“减缓”)O3分解,其中对O3分解起催化作用的是OH-(填“OH-”或“H+”).
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
12.关于下列各图的叙述,正确的是( )
| A. | 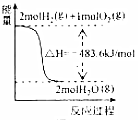 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 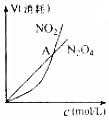 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 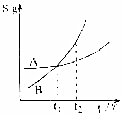 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 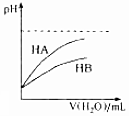 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
9.下列说法正确的是( )
| A. | pH均为2的醋酸和盐酸加水稀释100倍,所得溶液的pH:醋酸>盐酸 | |
| B. | pH为11的氨水和pH为3的盐酸溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol/L的NaOH溶液和CH3COONa溶液等体积混合后的溶液:c(Na+)+c(CH3COO-)=c(OH-)+c(H+) | |
| D. | 浓度均为0.1mol/L的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
10.常温下.弱碱MOH的电离常数K=1.0×10-3,0.1mol•L-1 MOH溶液的pH约为( )
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |