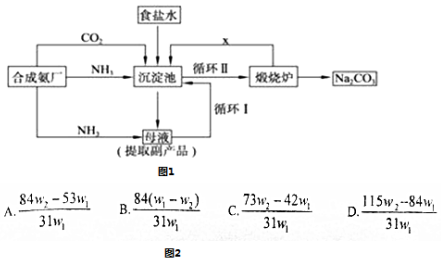
题目内容
5.写出下列物质在水溶液中的电离方程式:(1)MgCl2MgCl2=Mg2++2Cl-; (2)Ba(OH)2Ba(OH)2=Ba2++2OH-;(3)NaHSO4NaHSO4═Na++H++SO42-; (4)K2CO3K2CO3=2K++CO32-.
分析 (1)氯化镁为强电解质,完全电离出镁离子和氯离子;
(2)氢氧化钡为强电解质,完全电离出钡离子和氢氧根离子;
(3)NaHSO4为强电解质,完全电离出钠离子、氢离子、硫酸根离子;
(4)碳酸钾属于盐,为强电解质,完全电离出钾离子、碳酸根离子.
解答 解:(1)氯化镁为强酸强碱盐,属于强电解质,完全电离,电离方程式:MgCl2=Mg2++2Cl-,
故答案为:MgCl2=Mg2++2Cl-;
(2)氢氧化钡为二元强碱,属于强电解质,完全一步电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
(3)NaHSO4为强酸的酸式盐,属于强电解质,电离方程式为NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-;
(4)碳酸钾属于盐,为强电解质,完全电离,电离方程式:K2CO3=2K++CO32-,
故答案为:K2CO3=2K++CO32-.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱是解题关键,注意弱电解质用可逆号,强电解质用等号,并遵循电荷守恒、质量守恒定律,注意弱酸的酸式根离子不能拆,强酸的酸式酸根离子应电离出氢离子,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.一定温度下,两恒容容器中分别发生两个反应:①2X(g)+Y(g)?2Z(g);②A(g)+B(g)?C(g)+D(g),以下说法中,能说明反应①已经达到化学平衡状态、但不能说明反应②已经达到化学平衡状态的是( )
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |
20.关于某溶液中所含物质的鉴别,下列判断正确的是( )
| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
10.标准状况下,将2.24LCO2气体通入150mL1.00mol•L-1 NaOH溶液中,充分反应后溶液中c(CO32-)与c(HCO3-)的比值为(不考虑CO32-、HCO3-的水解)( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 1:3 |
17. 某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
 某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )
某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓氨水 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
14.下列四种物质的结构图中,小黑球代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,示例:如 ),下列说法正确的是( )
),下列说法正确的是( )
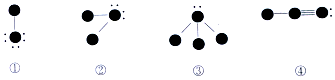
 ),下列说法正确的是( )
),下列说法正确的是( )
| A. | 四种物质中摩尔质量最大的是③ | B. | ①与③反应生成一种离子化合物 | ||
| C. | ④中含有非极性共价健 | D. | 该四种化合物涉及6种元素 |
15.下列溶液中物质的量浓度关系正确的是( )
| A. | 室温,0.1mol•L-1的CH3COOH溶液中:c(CH3COOH)<c(CH3COO-) | |
| B. | 1L 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 室温,0.1mol•L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa<Na2CO3 | |
| D. | 向0.01mol•L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO${\;}_{4}^{2-}$)>c(Na+)>c(OH-)=c(H+) |