题目内容
4. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
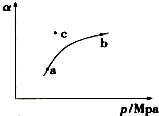
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
分析 (1)温度相同,平衡常数相同,反应2SO2(g)+O2(g) $\frac{\underline{催化剂}}{△}$2SO3(g),正反应是气体体积减少的反应,所以增大压强,平衡正向移动,三氧化硫的浓度变大;c点在对应的压强下最终要达平衡状态,所以二氧化硫的转化率减小,反应逆向进行;
(2)先求出O2的化学平衡时,再求出v(SO2)的反应速率,反应速率之比等于化学计量数之比;根据平衡移动原理以及生成物的浓度可知:T1>T2;
(3)①NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,且电离程度大于水解,若往溶液中加入氨水至中性依据溶液中物料守恒分析离子浓度关系;
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,氢氧化钠溶解电离出的氢氧根离子抑制亚硫酸钠的水解,溶液中钠离子浓度增大.
解答 解:(1)温度相同,平衡常数相同,反应2SO2(g)+O2(g) $\frac{\underline{催化剂}}{△}$2SO3(g),正反应是气体体积减少的反应,所以增大压强,平衡正向移动,三氧化硫的浓度变大,所以c(a)小于 (b);c点在对应的压强下最终要达平衡状态,所以二氧化硫的转化率减小,反应逆向进行,所以υ(正)<υ(逆),
故答案为:=;<;<;
(2)①由表中数据,v(O2)=$\frac{\frac{2mol-0.8mol}{2L}}{tmin}$=$\frac{1.2}{2t}$mol•L-1•min-1;
根据反应速率之比等于化学计量数之比,则v(SO2)=2v(O2)=2×$\frac{1.2}{2t}$mol•L-1•min-1=$\frac{1.2}{t}$mol•L-1•min-1,
故答案为:$\frac{1.2}{t}$mol•L-1•min-1 ;
②实验2中,n(SO2)参加?(4-0.4)mol=3.6mol
n(O2)消耗=0.5n(SO2)=1.8mol
平衡时n(O2)=(2-1.8)mol=0.2mol,而实验1中n(O2)=0.8mol 而开始时反应物的起始量相等,实验1到实验2的过程,相当于平衡向正反应方向移动,根据平衡移动原理,降温能使平衡向正反应方向移动,即T1>T2,
故答案为:反应放热,温度升高,平衡向左移动,反应物转化率低.
(3)①由于NaHSO3溶液中既存在电离平衡又存在水解平衡:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,HSO3-的电离平衡程度大于其水解平衡程度,溶液中c(H+)>c(OH-),故溶液显酸性,若往溶液中加入氨水至中性,溶液中存在物料守恒,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),
故答案为:HSO3-的电离程度大于水解程度;=;
②亚硫酸钠溶液中亚硫酸根离子水解,溶液显碱性,往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,氢氧化钠溶解电离出的氢氧根离子抑制亚硫酸钠的水解,溶液中钠离子浓度增大,完全溶解后溶液中c(Na+):c(SO32-)的比值变大,
故答案为:变大.
点评 本题涉及的知识点较多,关键要掌握有关可逆反应的计算、化学平衡移动原理以及图象的分析和解答等,题目难度中等.

①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
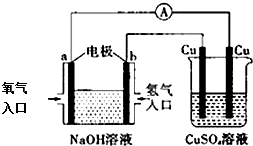
| A. | 该装置中a极为负极 | |
| B. | 该装置中b极的电极反应式是:2H++2e-=H2↑ | |
| C. | 一段时间后,左边装置中溶液pH增大 | |
| D. | CuSO4溶液浓度保持不变 |
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 | |
| C. | pH=9的CH3COONa溶液和PH=9的NaOH溶液中,水的电离程度相当 | |
| D. | 以金属铝为阳极电解足量的NaOH溶液,阳极区域没有沉淀生成 |
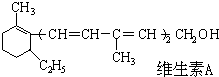
| A. | 维生素A的一个分子中有五个双键 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 维生素A是一种烯烃 |

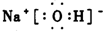 ;
;