题目内容
14.已维生素A的结构简式如图,关于它的叙述中不正确的是( )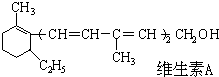
| A. | 维生素A的一个分子中有五个双键 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 维生素A是一种烯烃 |
分析 由结构可知,分子中含C、H、O三种元素,含碳碳双键、-OH,结合烯烃及醇的性质来解答;分析维生素A的结构简式可知,分子中不含苯环,含有5个C=C键和1个-OH,结合有机物的结构解答该题.
解答 解:A.由结构简式可知维生素A的一个分子中有5个C=C键双键,故A正确;
B.由结构简式可知分子式为C20H30O,维生素A的一个分子中含有30个H原子,故B正确;
C.维生素A中含有碳碳双键,能与溴水发生加成褪色,也能被酸性KMnO4溶液氧化,故C正确;
D.只有碳氢两种元素组成的化合物是烃,维生素A中含有氧元素,不是烃,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握结构中的官能团为解答的关键,熟悉烯烃、醇的性质即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
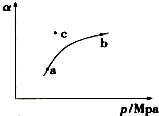
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
(2)实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1,温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
5.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
2.下列实验方案设计中,可行的是( )
| A. | 加稀硝酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 | |
| D. | 用澄清石灰水试液鉴别SO2和CO2两种气体 |
6.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:
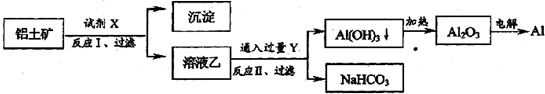
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A. | 试剂X为稀硫酸 | |
| B. | 反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| C. | 结合质子( H+)的能力由强到弱的顺序是:OH->HCO3->AlO2- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
3.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,12C碳-12原子所含有的碳原子数目的物质的量为1摩 |
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 50 mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |