题目内容
14.金属、非金属及其化合物在生产生活及化学实验中都有着广泛应用,请完成下列各题.(1)中国的瓷器驰名世界,制备陶瓷是以粘土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成.若以氧化物形式表示粘土的组成,应写为:Al2O3.2SiO2.2H2O.
(2)如果胃酸过多,可服用Al(OH)3、NaHCO3(填写化学式)缓解症状,但如果患有胃溃疡,则不能服用NaHCO3,以防止胃穿孔.
(3)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为:SiO2+4HF=SiF4↑+2H2O.
(4)刻制印刷电路时,要用FeCl3作为“腐蚀液”将铜箔腐蚀,原理是(写离子方程式)Cu+2Fe3+=Cu2++2Fe2+.
(5)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气.写出该反应的离子方程式:2ClO3-+4H++2Cl-=Cl2↑+2ClO2+2H2O.
(6)高锰酸钾是实验室中一种常用的氧化剂,可与许多还原性物质反应,如SO2可以使酸性高锰酸钾溶液褪色,请写出这一过程离子方程式:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)氢氧化铝和盐酸反应生成三氯化铝和水;小苏打(NaHCO3)和盐酸反应生成氯化钠、水和二氧化碳;
(3)二氧化硅和氢氟酸反应生成四氟化硅;
(4)三价铁离子具有强的氧化性,能够氧化铜生成铜离子和二价铁离子;
(5)氯酸钠和浓盐酸反应能生成二氧化氯、氯气、水和氯化钠;
(6)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水.
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,[Al2Si2O5(OH)4]可改成Al2O3.2SiO2.2H2O,
故答案为:Al2O3.2SiO2.2H2O;
(2)氢氧化铝和盐酸反应生成三氯化铝和水:Al(OH)3+HCl=AlCl3+H2O,小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳:NaHCO3+HCl=NaCl+H2O+CO2↑,生成二氧化碳会引起胃穿孔,
故答案为:Al(OH)3、NaHCO3;NaHCO3;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)三价铁离子具有强的氧化性,能够氧化铜生成铜离子和二价铁离子,离子方程式:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(5)用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,氯酸钠和浓盐酸反应的离子化学方程式为:2ClO3-+4H++2Cl-=Cl2↑+2ClO2+2H2O,
故答案为:2ClO3-+4H++2Cl-=Cl2↑+2ClO2+2H2O.
(6)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水,其反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写、离子方程式,明确物质的性质是解本题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 水玻璃和硫酸亚铁溶液长期暴露在空气中均易变质 | |
| B. | SO2和CO2通入CaCl2溶液中均无明显现象 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | SO2、漂白粉、活性炭都能使红墨水褪色 |
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
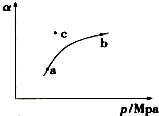
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
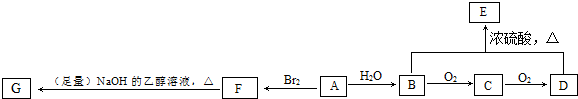
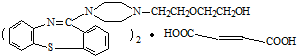 ,它的合成路线如下:
,它的合成路线如下: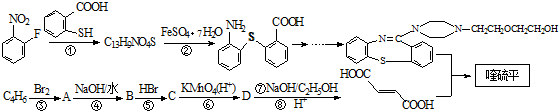
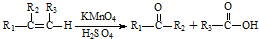
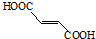 含有的官能团名称为碳碳双键和羧基.
含有的官能团名称为碳碳双键和羧基.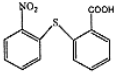 .
.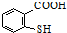 在一定条件下发生缩聚反应的化学方程式为
在一定条件下发生缩聚反应的化学方程式为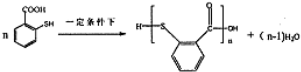 .
.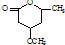 是一种重要的有机化合物.请设计合理方案,完成从
是一种重要的有机化合物.请设计合理方案,完成从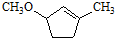 到
到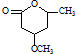 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).