题目内容
9.根据下图所示的装置,判断下列说法正确的是( )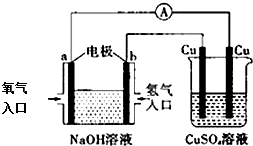
| A. | 该装置中a极为负极 | |
| B. | 该装置中b极的电极反应式是:2H++2e-=H2↑ | |
| C. | 一段时间后,左边装置中溶液pH增大 | |
| D. | CuSO4溶液浓度保持不变 |
分析 左侧为原电池,通入氧气的一极为正极,发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,通入氢气的一极为负极,发生氧化反应,电极方程式为H2+2OH--2e-=2H2O,右侧为电解池,阳极上铜失电子生成铜离子,阴极铜离子得电子生成Cu,以此解答该题.
解答 解:A.该装置中a极通入的是氧气,氧气在正极得电子,所以a为正极,故A错误;
B.碱性条件下,氢气失电子生成水,则b极的电极反应式是:H2+2OH--2e-=2H2O,故B错误;
C.左边装置中的总反应是2H2+O2=2H2O,反应一段时间,溶液中氢氧化钠的浓度减小,所以溶液pH减小,故C错误;
D.右侧为电解池,Cu为阳极,阳极上铜失电子生成铜离子,Cu为阴极,阴极上铜离子得电子生成Cu,所以硫酸铜溶液的浓度不变,故D正确.
故选D.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力的考查,难度不大,注意把握电极方程式的书写,为解答该题的关键.

练习册系列答案
相关题目
17.下列说法不正确的是( )
①质子数相同的粒子一定属于同一种元素②同位素的性质完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数.
①质子数相同的粒子一定属于同一种元素②同位素的性质完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数.
| A. | ②③⑤ | B. | ①②④⑤ | C. | ①②⑤ | D. | ③④⑤ |
4. 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
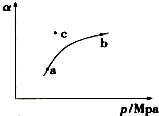
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
(2)实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1,温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
14.下列有关化工生产的说法正确的是( )
| A. | 工业生产硫酸时,常用NaOH吸收尾气中的少量SO2 | |
| B. | 利用Fe3+作为混凝剂,可以对硬水进行软化 | |
| C. | N2与O2作用生成NO,属于氮的固定 | |
| D. | 石油的分馏、煤的气化或液化都是物理变化 |
1.在通常情况下呈黄绿色的气体是( )
| A. | NO2 | B. | NO | C. | Cl2 | D. | SO2 |
18.下列关于苯酚的叙述中,正确的是( )
| A. | 苯酚呈弱酸性,能使石蕊试液显浅红色 | |
| B. | 苯酚分子中的13个原子有可能处于同一平面上 | |
| C. | 苯酚可以和硝酸发生加成反应 | |
| D. | 苯酚能与FeCl3溶液反应生成紫色沉淀 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.