题目内容
13.过氧化钠在呼吸面具或潜水艇中作为供氧剂的来源,其化学反应方程式为2Na2O2+2CO2═2Na2CO3+O2;红热的铁跟水蒸气反应,反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.分析 过氧化钠和二氧化碳反应生成碳酸钠和氧气;红热的铁跟水蒸气反应生成四氧化三铁和氢气.
解答 解:过氧化钠和二氧化碳反应生成碳酸钠和氧气,所以潜水艇中作为供氧剂,反应方程式为2Na2O2+2CO2═2Na2CO3+O2,红热的铁跟水蒸气反应生成四氧化三铁和氢气,故化学方程为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:供氧剂;2Na2O2+2CO2═2Na2CO3+O2;3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查化学方程式和离子方程式的书写,学生只要按照书写方程的一般步骤去写就可以了!

练习册系列答案
相关题目
3.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
①HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
4.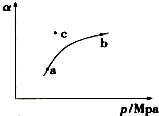 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
(2)实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1,温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
1.在通常情况下呈黄绿色的气体是( )
| A. | NO2 | B. | NO | C. | Cl2 | D. | SO2 |
8.下列说法正确的是( )
| A. | 碳酸钙难溶于水,所以碳酸钙属于非电解质 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化 | |
| D. | 将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝 |
18.下列关于苯酚的叙述中,正确的是( )
| A. | 苯酚呈弱酸性,能使石蕊试液显浅红色 | |
| B. | 苯酚分子中的13个原子有可能处于同一平面上 | |
| C. | 苯酚可以和硝酸发生加成反应 | |
| D. | 苯酚能与FeCl3溶液反应生成紫色沉淀 |
5.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
2.下列实验方案设计中,可行的是( )
| A. | 加稀硝酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 | |
| D. | 用澄清石灰水试液鉴别SO2和CO2两种气体 |
3.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,12C碳-12原子所含有的碳原子数目的物质的量为1摩 |