题目内容
12.A-I是中学化学中的常见化学物质,有关物质的转化关系如图所示(部分物质和条件已略去).X是一种气体单质,所含元素在地壳中含量最多;Y是一种常见的无色液体;A是由两种元素组成的化合物,其摩尔质量为4lg/mol;B是一种常见的强碱,焰色反应呈黄色;湿润的红色石蕊试纸遇气体D变蓝;I是一种强酸.故要求回答下列问题: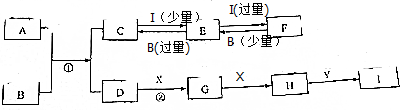
(1)E的化学式Al(OH)3;
(2)B的电子式
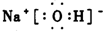 ;
;(3)反肉①的离子方程式AlN+OH-+H2O=AlO2-+NH3;
(4)反应②的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 X是一种气体单质,所含元素在地壳中含量最多,则I为O2;Y是一种常见的无色液体,应为H2O;B是一种常见的强碱,焰色反应呈黄色,应为NaOH;湿润的红色石蕊试纸遇气体D变蓝,应为NH3,由转化关系可知G为NO,H为NO2,I是一种强酸,应为HNO3,可说明A中含有N元素,且是由两种元素组成的化合物,其摩尔质量为4lg/mol,可知A应为AlN,则C为NaAlO2,E为Al(OH)3,F为Al(NO3)3,以此解答该题.
解答 解:X是一种气体单质,所含元素在地壳中含量最多,则I为O2;Y是一种常见的无色液体,应为H2O;B是一种常见的强碱,焰色反应呈黄色,应为NaOH;湿润的红色石蕊试纸遇气体D变蓝,应为NH3,由转化关系可知G为NO,H为NO2,I是一种强酸,应为HNO3,可说明A中含有N元素,且是由两种元素组成的化合物,其摩尔质量为4lg/mol,可知A应为AlN,则C为NaAlO2,E为Al(OH)3,F为Al(NO3)3,
(1)由以上分析可知E为Al(OH)3,故答案为:Al(OH)3;
(2)B为NaOH,电子式为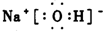 ,故答案为:
,故答案为: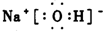 ;
;
(3)反肉①为AlN与氢氧化钠的反应,生成偏铝酸钠和氨气,反应的离子方程式为AlN+OH-+H2O=AlO2-+NH3,故答案为:AlN+OH-+H2O=AlO2-+NH3;
(4)反应②为氨气的催化氧化,方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了物质转化关系分析判断,主要是铝及其化合物性质,氮及其化合物性质的分析应用,注意反应特征的理解应用是解题关键,题目难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
①质子数相同的粒子一定属于同一种元素②同位素的性质完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数.
| A. | ②③⑤ | B. | ①②④⑤ | C. | ①②⑤ | D. | ③④⑤ |
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
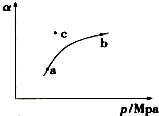
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
| A. | NO2 | B. | NO | C. | Cl2 | D. | SO2 |
| A. | 加稀硝酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 | |
| D. | 用澄清石灰水试液鉴别SO2和CO2两种气体 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.