题目内容
16.下列说法正确的是( )| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于浓盐酸中,然后稀释至所需浓度 | |
| C. | pH=9的CH3COONa溶液和PH=9的NaOH溶液中,水的电离程度相当 | |
| D. | 以金属铝为阳极电解足量的NaOH溶液,阳极区域没有沉淀生成 |
分析 A、氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解;而硫酸铝水解生成氢氧化铝和硫酸,硫酸是不挥发性酸;
B、加入盐酸,引入新杂质;
C、在碱溶液中,水的电离被抑制,而在强碱弱酸盐中,水的电离被促进;
D、以金属铝为阳极电解足量的NaOH溶液,阳极的电极方程式为:Al-3e-=Al3+.
解答 解:A、氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解生成氧化铝和水蒸气,所以得到的固体为Al2O3;硫酸铝水解生成氢氧化铝和硫酸,加热促进硫酸铝水解,因为硫酸没有挥发性,所以得到的固体仍然是Al2(SO4)3,故A错误;
B、加入盐酸,引入新杂质,为抑制水解,可加入少量硫酸,故B错误;
C、在碱溶液中,水的电离被抑制,而在强碱弱酸盐中,水的电离被促进,故pH=9的NaOH溶液中,水电离程度小于pH=9的醋酸钠溶液,故C错误;
D、以金属铝为阳极电解足量的NaOH溶液,阳极的电极方程式为:Al-3e-=Al3+,由于氢氧化钠溶液足量,故Al3+和OH-发生反应:Al3++4OH-=AlO2-+2H2O,故无沉淀生成,故D正确.
故选D.
点评 本题考查了盐类水解的应用以及电解池中电极反应的书写,难度不大,应注意的是铝离子和过量的氢氧化钠反应生成偏铝酸盐,无沉淀生成.

练习册系列答案
相关题目
6.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
4.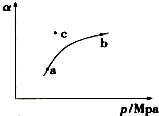 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
(2)实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为$\frac{1.2}{t}$mol•L-1•min-1,温度T1大于T2的理由是反应放热,温度升高,平衡向左移动,反应物转化率低.
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)?△催化剂 2SO3(g)+Q
某温度下,测得SO2(g)的平衡转化率(a)与体系总压强( p )的关系如图所示.
(1)a、b两点对应的平衡常数K(a)= K(b) (填“>”、“<”或“=”,下同),SO3浓度c(a)<c(b).c点时,反应速率υ(正)<υ(逆).将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
(3)制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐.
①0.1mol/L的NaHSO3溶液中c(H+)>c(OH-),用水解和电离理论的角度解释其原因HSO3-的电离程度大于水解程度,若往溶液中加入氨水至中性,则c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、“<”或“=”).
②往0.1mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+):c(SO32-)的比值变大(填“变大”、“变小”或“保持不变”).
1.在通常情况下呈黄绿色的气体是( )
| A. | NO2 | B. | NO | C. | Cl2 | D. | SO2 |
8.下列说法正确的是( )
| A. | 碳酸钙难溶于水,所以碳酸钙属于非电解质 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化 | |
| D. | 将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝 |
5.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
6.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:

对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A. | 试剂X为稀硫酸 | |
| B. | 反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| C. | 结合质子( H+)的能力由强到弱的顺序是:OH->HCO3->AlO2- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |