题目内容
16.常温下H2S饱和溶液1L,其浓度为0.1mol/L,电离方程式为H2S?H++HS-,HS-?H++S2-若要使溶液中的pH值增大同时使c(S2-)减小,可采取的措施是( )| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
分析 H2S的电离方程式为:H2S?H++HS-、HS-=S2-+H+,若要使溶液的pH增大,可使平衡逆向移动,或加入碱性物质使平衡正向移动或加入水稀释,c(S2-)减小,可加水稀释或加入能与硫离子反应的物质,以此解答该题.
解答 解:A.加入适量水能促进水的电离,但导致溶液中氢离子浓度和硫离子浓度都减小,溶液的pH值增大,故A正确;
B.氢硫酸和氢氧化钠反应生成硫化钠和水,反应方程式为:H2S+2NaOH=Na2S+H2O,所以加入氢氧化钠后促进氢硫酸的电离,使硫离子浓度增大,氢离子浓度减小,故B错误;
C.通入适量的O2,发生反应2H2S+O2=2H2O+2S,溶液中的pH值增大,同时c(S2-)减小,故C正确;
D.氢硫酸和硫酸铜的反应方程式为:H2S+CuSO4=CuS↓+H2SO4,弱酸变成强酸溶液,溶液的PH值减小,硫离子和铜离子生成硫化铜沉淀导致硫离子浓度降低,故D错误.
故选AC.
点评 本题考查了弱电解质的电离,为高频考点,明确物质间的反应是解本题关键,根据溶液中参加反应的离子来确定离子浓度变化,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是( )
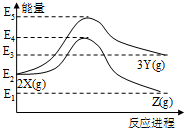

| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
10.已知反应A(s)+B(g)?C(g)+D(g)的化学平衡常数和温度的关系如表:
下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
4.活性炭可处理大气污染物NO,反应原理:C(s)+2NO(g)?N2(g)+CO2(g)△H>0.T℃时,在2L密闭容器中加入0.100mol NO和2.030mol活性炭(无杂质),平衡时活性炭物质的量是2.000mol.下列说法不合理的是( )
| A. | 该温度下的平衡常数是:K=$\frac{9}{16}$ | |
| B. | 达到平衡时,NO的转化率是60% | |
| C. | 3min末达到平衡,则v(NO)=0.01mol/(L•min) | |
| D. | 升高温度有利于活性炭处理更多的污染物NO |
11.在容积不变的密闭容器中通入一定量的A发生反应:2A(g)?B(g)+C(g)△H>0.T1温度下的部分实验数据为:
下列说法正确的是( )
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
1.在某温度下2L密闭容器中,3种气体加入起始状态和平衡状态时的物质的量(n)如下表所示:
下列有关说法正确的是( )
| X | Y | W | |
| 起始状态(mol) | 2 | 1 | 0 |
| 平衡状态(mol) | 1 | 0.5 | 1.5 |
| A. | 该温度下,该反应的平衡常数K=9 | |
| B. | 升高温度,若W的体积分数减小,此反应△H>0 | |
| C. | 该温度下,该反应的方程式为 2X(g)+Y(g)?3W(g) | |
| D. | 增大压强,正、逆反应速率都增大,平衡向正反应方向移动 |
8.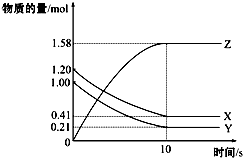 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 在前10s内用X、Y、Z表示的反应速率数值相等 |
6.下列实验设计方案中,可行的是( )
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
