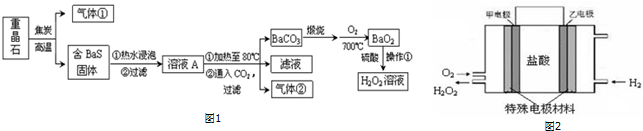
题目内容
6.下列实验设计方案中,可行的是( )| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
分析 A.二氧化碳气体能够与氢氧化钠溶液反应;
B.碳酸钾与盐酸反应生成氯化钾好、二氧化碳气体和水;
C.生成的沉淀可能为氯化银,无法排除银离子的干扰;
D.只有硫酸钠、硫酸与氯化钡溶液反应,且反应现象相同,无法用氯化钡溶液鉴别五种溶液.
解答 解:A.除去CO2中的少量HCl,二氧化碳和氯化氢都与NaOH溶液反应,不能用氢氧化钠溶液,可以用饱和碳酸氢钠溶液,故A错误;
B.碳酸钾与盐酸反应生成氯化钾,且氯化氢易挥发,可用盐酸除去KCl溶液中的少量K2CO3,故B正确;
C.检验硫酸根离子时,应该先向溶液中加入稀盐酸排除干扰,然后加入氯化钡溶液,否则无法排除银离子的干扰,故C错误;
D.BaCl2溶液只与硫酸、硫酸钠反应,且都生成硫酸钡沉淀,无法用氯化钡溶液鉴别盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、物质的分离与提纯、物质鉴别等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.常温下H2S饱和溶液1L,其浓度为0.1mol/L,电离方程式为H2S?H++HS-,HS-?H++S2-若要使溶液中的pH值增大同时使c(S2-)减小,可采取的措施是( )
| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
1.下列离子方程式书写不正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
18.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:
(1)取实验2后的溶液,进行如图实验:
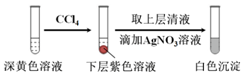
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.
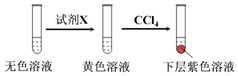
其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关.
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
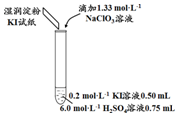 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.

其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |