题目内容
5.某矿样含有大量的CuS及少量其它不溶于酸的杂质.实验室中以该矿样为原料制备CuCl2•2H2O晶体,流程如图1:
(1)在实验室中,欲用37%(密度为1.19g•mL-1)的盐酸配制500mL 6mol•L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒、500mL容量瓶外,还有胶头滴管;
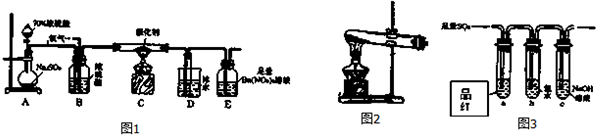
(2)①若在实验室中完成系列操作a.则下列如图2实验操作中,不需要的是cd(填下列各项中序号).
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl═CuCl42-(黄色)+4H2O.欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是c(填序号).
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如图3所示.
①CuS矿样在焙烧过程中,有Cu2S、CuO•CuSO4、CuSO4、CuO生成,转化顺序为:
CuS$\stackrel{①}{→}$Cu2S$\stackrel{②}{→}$CuO•CuSO4$\stackrel{③}{→}$CuSO4$\stackrel{④}{→}$CuO
第①步转化主要在200~300℃范围内进行,该步转化的化学方程式为2CuS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+SO2,
②300~400℃范围内,固体质量明显增加的原因是Cu2S转化为CuSO4,如图3所示过程中,CuSO4固体能稳定存在的阶段是c(填下列各项中序号).
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如图4装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物.
a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作:关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,则气密性.
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物.你认为装置D中原来盛有的溶液为氯化钡溶液.
分析 (1)根据配制500mL 6mol•L-1的盐酸的步骤选择使用的仪器;
(2)①操作a为从氯化铜溶液中得到CuCl2•2H2O,操作方法按照操作顺序依次是:蒸发浓缩、冷却结晶、过滤,据此进行解答;
②根据影响化学平衡Cu(H2O)42+(蓝色)+4Cl-═CuCl42-(黄色)+4H2O的因素进行分析,注意铁离子和铜离子自身颜色会影响实验结果;
(3)①第①步反应为氯化铜与氧气反应生成硫化亚铜和二氧化硫,据此写出反应的化学方程式;
②根据固体质量变化曲线及SO2生成曲线可知,300~400℃范围内二氧化硫含量达到最低,说明反应生成了硫酸铜,使固体质量明显增加;根据固体为硫酸铜时固体的质量最大进行分析;
③a.关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出;
b.二氧化硫与氧气的混合气体能够与氯化钡生成硫酸钡沉淀,可以使用氯化钡溶液检验.
解答 解:(1)配制500mL 6mol•L-1的盐酸需要的仪器有:量筒、烧杯、500mL容量瓶、玻璃棒外、胶头滴管,使用还缺少:胶头滴管、500mL容量瓶,
故答案为:胶头滴管;
(2)①操作a实验的目的是从氯化铜溶液中得到CuCl2•2H2O,需要的操作方法按照操作顺序依次是:蒸发浓缩、冷却结晶和过滤,所以需要的装置为a、b,不需要的为c和d,
故答案为:cd;
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-═CuCl42-(黄色)+4H2O,欲用实验证明滤液A(绿色)中存在上述平衡,则需要改变条件,看是否有平衡移动,因此实验中进入水后溶液蓝色加深,即可证明存在平衡;不能加入氯化铁固体或氯化铜固体,原因是铁离子和铁离子本身有颜色,实验c正确,
故答案为:c;
(3)①根据CuS矿样在焙烧过程中转化顺序可知,第①步反应为氯化铜转化成硫化亚铜,反应的化学方程式为:2CuS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+SO2,
故答案为:2CuS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+SO2;
②根据图象曲线变化可知,300~400℃范围内固体有硫化亚铜转化为硫酸铜,所以固体质量明显增加;当固体质量最大时,固体的主要成分为硫酸铜,所以CuSO4固体能稳定存在的阶段为第三阶段,
故答案为:Cu2S转化为CuSO4;c;
③a.关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,
故答案为:关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,则气密性好;
b.第四阶段所得气体为SO2和O2的混合物,二氧化硫与氧气能够与氯化钡溶液反应生成难溶物硫酸钡,所以装置D可以使用氯化钡溶液检验二氧化硫和氧气,
故答案为:氯化钡.
点评 本题考查了一定物质的量浓度的溶液配制方法、CuCl2•2H2O晶体的制备方法、性质实验方案的设计、化学平衡的影响因素等知识,题目难度较大,试题涉及的知识点较多,题量较大,充分考查了学生对书写知识掌握情况,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
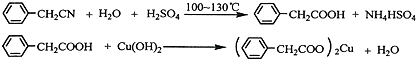
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: