题目内容
8.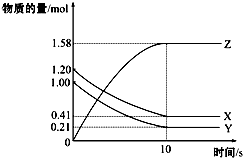 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 在前10s内用X、Y、Z表示的反应速率数值相等 |
分析 根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20-0.41)mol=0.79mol,△n(Y)=(1.00-0.21)mol=0.79mol,△n(Z)=(1.58-0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,据此写化学方程式,根据相关概念及公式进行反应速率、转化率的计算,以此解答该题.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.0395mol/L,故B错误;
C.反应开始到10s时,Y的转化率为$\frac{1.0mol-0.21mol}{1.0mol}$×100%=19.0%,故C正确;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到3min时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)?2Z(g),反应速率之比等于化学计量数之比,则反应速率之比为1:1:2,故D错误.
故选C.
点评 本题考查化学平衡图象问题,为高考常见题型,侧重于学生的分析、计算能力的考查,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.

练习册系列答案
相关题目
1.下列有关物质的分类正确的是( )
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
16.常温下H2S饱和溶液1L,其浓度为0.1mol/L,电离方程式为H2S?H++HS-,HS-?H++S2-若要使溶液中的pH值增大同时使c(S2-)减小,可采取的措施是( )
| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
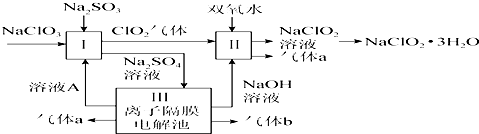
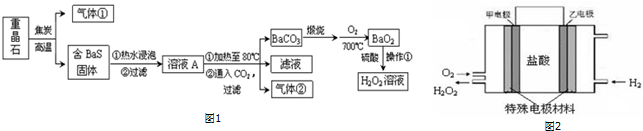
18.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:
(1)取实验2后的溶液,进行如图实验:
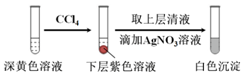
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.
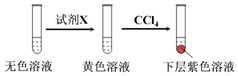
其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关.
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
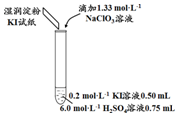 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.

其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
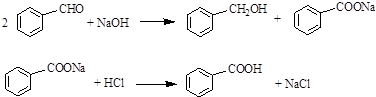
 .
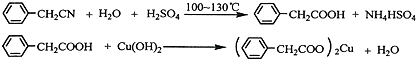
. 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: