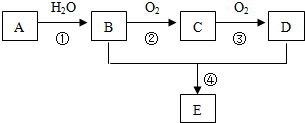
题目内容
4. 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:(1)如图所示的仪器中配置溶液肯定不需要的是AC(填序号),配制上述溶液还需用到玻璃仪器是烧杯和玻璃棒(填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为2.0g.
(3)更好用计算得知,所需质量分数为98%,密度为1.84g/cm3的浓硫酸的体积为13.6mL.如果实验室有15mL、20mL、50mL量筒,应选用15mL的量筒最好.
(4)取用任意体积的所配0.5mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的BD(填字母).
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液中的$S{O_4}^{2-}$的数目 D.溶液的密度
(5)将所配置的稀H2SO4进行测定,发现浓度大于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏大(填写字母)C.
A.烧杯未进行洗涤
B.配置前,容量瓶中有少量蒸馏水
C.在容量瓶中定容时俯视容量瓶刻度线
D.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
分析 (1)根据各仪器的作用选取仪器;
(2)由于实验室无450mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,根据质量m=CVM来计算;
(3)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(4)根据各物理量的多少与体积是否有关判断.
(5)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)用容量瓶配制溶液,用胶头滴管定容;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,
故答案为:AC;烧杯和玻璃棒;
(2)由于实验室无450mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,故所需的氢氧化钠的质量m=CVM=0.1mol/L×0.5L×40g/mol=2.0g,故答案为:2.0;
(3)根据“大而近”的原则,根据需要量取的浓硫酸的体积为13.6mL可知应选择15mL的量筒,故答案为:15;
(4)A.溶液中H2SO4的物质的量n=CV,所以与溶液的体积有关,故错误.
B.溶液的浓度c=$\frac{1000ρω}{M}$,与所量取的体积无关,故正确.
C.溶液中SO42-的数目N=CVNA,所以与溶液的体积有关,故错误.
D.溶液的密度与所量取溶液的体积无关,故正确.
故选:BD;
(5)A.烧杯未进行洗涤,会导致溶质的损失,则浓度偏低,故A错误;
B.配置前,容量瓶中有少量蒸馏水,对溶液浓度无影响,故B错误;
C.在容量瓶中定容时俯视容量瓶刻度线,则溶液体积偏小,故浓度偏高,故C正确;
D.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线是正常的,再加水至刻度线会导致浓度偏低,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,易错题是(2)题,注意需要450mL溶液,因为没有450mL的容量瓶,有500mL的容量瓶,所以要配制500mL溶液,所称量固体的质量或量取溶液的体积应等于配制500mL溶液时所用的量.

| A. | 肯定含有SO2和NO | B. | 肯定含有NO和O2 | ||
| C. | 可能有Cl2 | D. | 肯定没有Cl2、NO2,可能有O2 |
| 阳离子 | Fe2+、Na+、Ba2+、Al3+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
(1)A溶液的颜色反应为黄色,则A溶液中含有的金属离子是Na+(填离子序号).
(2)将A的水溶液逐滴加入C中,先生成白色沉淀,后白色沉淀逐渐溶解,请写出白色沉淀逐渐溶解的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)B溶液与D溶液反应生成不溶于稀硝酸的白色沉淀,请写出该反应的离子方程式Ba2++SO42-=BaSO4↓.
Ⅱ.(4)据此推断它们是(写化学式)ANaOH;DBa(NO3
)2.
(5)A溶液与B溶液反应的现象为先生成白色絮状沉淀,然后变为灰绿色,最后变为红褐色.
| A. | 125.0克CuSO4•5H2O 晶体 | B. | 76.8克无水CuSO4 固体 | ||
| C. | 120.0克CuSO4•5H2O 晶体 | D. | 40.0克无水CuSO4固体 |
| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
| A. | 氟原子的结构示意图: | B. | 塑料王聚四氟乙烯的结构简式: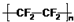 | ||
| C. | 中子数为10的氟原子:${\;}_{9}^{19}$F | D. | 萤石主要成分CaF2电子式: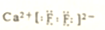 |
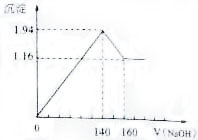 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;