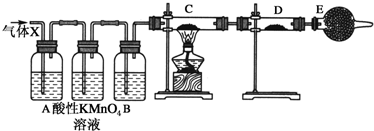
题目内容
9.某同学将质量为m1g的NaHCO3固体放在试管中加热片刻,冷却后测得剩余固体的质量为m2g,试管中发生的反应的化学方程式是2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成Na2CO3的质量为$\frac{106({m}_{1}-{m}_{2})}{62}$.分析 碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,书写化学方程式,根据差量进行计算,由此分析解答.
解答 解:碳酸氢钠加热发生的反应方程式为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
根据差量法:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
106 62
m(Na2CO3) (m1-m2)g
碳酸钠的质量为:m(Na2CO3)=$\frac{106({m}_{1}-{m}_{2})}{62}$g,故答案为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;$\frac{106({m}_{1}-{m}_{2})}{62}$.
点评 本题考查了NaHCO3性质实验方案的设计,题目难度中等,正确理解题干信息为解答关键,注意差量法的应用.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.采用硫酸同槽浸出软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)的新工艺方法提取锰、铜、铁元素获得成功,生产流程如图所示:
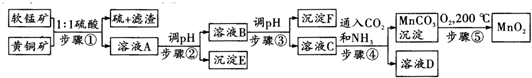
已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
根据表中数据,回答相关问题:
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.

已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
17.某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成份的判断正确的是( )
| A. | 肯定含有SO2和NO | B. | 肯定含有NO和O2 | ||
| C. | 可能有Cl2 | D. | 肯定没有Cl2、NO2,可能有O2 |
14.向含等物质的量浓度的FeI2、FeBr2混合溶液中通人适量氯气,下列离子反应一定不正确的是( )
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
1.下列不属于有机物的原子成键特点的是( )
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |
16.氟是卤族元素之-,由于氟的特殊化学性质,氟化学在化学发展史上有重要的地位.下列有关说法正确的是( )
| A. | 氟原子的结构示意图: | B. | 塑料王聚四氟乙烯的结构简式: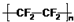 | ||
| C. | 中子数为10的氟原子:${\;}_{9}^{19}$F | D. | 萤石主要成分CaF2电子式: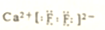 |