题目内容
15.将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
(1)原混合物中Mg和Al的质量之为3:2;
(2)生成的H2在标准状况下的体积为10.08L;
(3)加入NaOH溶液的物质的量浓度为5mol/L.
(4)稀硫酸的物质的量浓度为1.25mol/L.
分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;
当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4;
从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,
(1)由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,再根据m=nM计算;
(2)根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),据此计算n(H2),再根据V=nVm计算氢气体积;
(3)由200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,根据氢氧化铝物质的量计算n(NaOH),再根据c=$\frac{n}{V}$计算出;
(4)沉淀量最大,溶液中溶质为Na2SO4,根据钠元素守恒计算n(Na2SO4),再根据c=$\frac{n}{V}$计算.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;
当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,溶液中溶质为Na2SO4;
从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,
(1)由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的质量之比为:0.2mol×27g/mol:0.15mol×24g/mol=3:2,
故答案为:3:2;
(2)由A中可知n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L,
故答案为:10.08L;
(3)由200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为:$\frac{0.2mol}{0.24L-0.2L}$=5mol/L,
故答案为:5mol/L;
(4)沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于240mL氢氧化钠溶液中含有的n(NaOH)的$\frac{1}{2}$倍,所以n(Na2SO4)=$\frac{1}{2}$×0.2L×5mol/L=0.5mol,所以硫酸的浓度为:$\frac{0.5mol}{0.4L}$=1.25mol/L,
故答案为:1.25mol/L.
点评 本题考查以图象题的形式考查镁铝的重要化合物、混合物反应的计算等,题目难度中等,注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用守恒计算.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1 mol Cu2S,同时生成22.4L SO2 | |
| D. | 有0.2 mol硫被氧化时,转移1.2NA个电子 |
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)N原子结构示意图为
 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第2周期中气态氢化物最稳定的是H2O;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是集成电路、半导体等(写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是NaCl该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2.
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
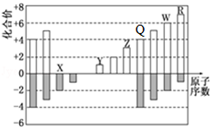
| A. | 原子半径:Z>Y>X | |
| B. | X和Z形成的化合物能溶于NaOH溶液 | |
| C. | Q和X形成的化合物不能与酸反应 | |
| D. | R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 溶液中OH?氧化了Mg |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中Mg也可被氧化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硅胶 | B. | 六水合氯化钙 | ||
| C. | 碱石灰 | D. | 具有吸水性的植物纤维 |
