题目内容
3.下列说法错误的是( )| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
分析 A.一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用;
B.铅蓄电池是二次电池,可以充电;
C.蓄电池是二次电池放电后可以充电重新使用;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能.
解答 解:A.一次电池是放电后不能进行使用,二次电池是放电后可以充电后继续使用,碱性锌锰电池是一次电池,故A错误;
B.铅蓄电池是二次电池,可以放电充电,故B正确;
C.蓄电池是二次电池放电后可以充电重新使用,使活性物质获得再生,故C正确;
D.燃料在两个电极上发生氧化还原反应把化学能转化为电能,不是在电池内部燃烧,故D正确;
故选A.
点评 本题考查了原电池的原理分析,为高频考点,注意电池分类,一次电池、二次电池的工作实质,把握原电池的分类以及工作原理,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
13.氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
14.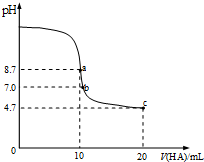 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA) | B. | a、c两点溶液中水的电离程度相同 | ||
| C. | b点溶液中:c(Na+)=c(A-)+c(HA) | D. | c点溶液中:c(A-)>c(HA) |
11.某有机物的结构简式为HOCH2CH2CHO,请完成下表,指出该有机物中的任意一种官能团,为该官能团提供一种简单的鉴别方法并简述实验现象,写出与鉴别方法有关的化学方程式.
| 官能团 | 选择试剂 | 实验现象 | 有关反应的化学方程式或离子方程式 |
18.下列有机物中,所有的碳原子不可能都共面的是( )
| A. |  | B. |  | C. |  | D. |  |
12.大气中的部分碘源于O3对海水中I?的氧化.某科学小组进行O3与含I?溶液反应的相关研究.
(1)O3将I?氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
用热化学方程式表示O3氧化I?生成I2的反应O3(g)+2I-(aq)+2H+(aq)═I2(aq)+H2O(l)+O2(g)△H=△H1+△H2+△H3.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
①在30℃、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
②pH增大能加速O3分解,表明对O3分解起催化作用的是OH-.
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为b、a、c(填字母代号).
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
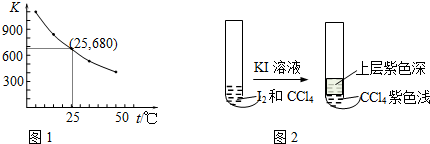
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是B.
A.反应I2(aq)+I-(aq)?I3-(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有I-、I2、I3-(用化学符号表示).
②由实验现象可推测关于I2溶解性的结论是在此温度下,I2在KI溶液中的溶解性比在CCl4中强.

(1)O3将I?氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)═IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
用热化学方程式表示O3氧化I?生成I2的反应O3(g)+2I-(aq)+2H+(aq)═I2(aq)+H2O(l)+O2(g)△H=△H1+△H2+△H3.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示.已知:O3的起始浓度为0.0216mol/L.
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②pH增大能加速O3分解,表明对O3分解起催化作用的是OH-.
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为b、a、c(填字母代号).
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是B.
A.反应I2(aq)+I-(aq)?I3-(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有I-、I2、I3-(用化学符号表示).
②由实验现象可推测关于I2溶解性的结论是在此温度下,I2在KI溶液中的溶解性比在CCl4中强.