题目内容
5.焙烧黄铜矿:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是( )| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1 mol Cu2S,同时生成22.4L SO2 | |
| D. | 有0.2 mol硫被氧化时,转移1.2NA个电子 |
分析 2CuFeS2+O2→Cu2S+2FeS+SO2中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.
解答 解:A.O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,则SO2既是氧化产物又是还原产物,故A正确;
B.Cu元素的化合价降低,S元素的化合价升高,则CuFeS2既作氧化剂又作还原剂,S元素被氧化,故B错误;
C.由反应可知,生成1 molCu2S,同时生成1molSO2,但状况未知,不能计算其体积,故C错误;
D.由反应可知,1molS被氧化转移6mol电子,则0.2mol硫被氧化,转移1.2 mol电子,转移1.2NA个电子,故D正确;
故选AD.
点评 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
15.如表各组物质中,不能按 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | MgO | MgCl2 | Mg(OH)2 |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | Na2CO3 | Na2SO3 |
| A. | A | B. | B | C. | C | D. | D |
16.实验室用5%的NaOH溶液洗涤硝基苯以除去其中的酸性杂质,洗涤时不要用到( )
| A. | 漏斗 | B. | 分液漏斗 | C. | 烧杯 | D. | 滤纸 |
13.氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
20.化学反应时,反应物的量不同,产物或现象可能会发生变化.下列正确的是( )
| A. | 硫在少量氧气中燃烧成SO2,过量能生成SO3 | |
| B. | 铁丝在少量氯气中燃烧生成FeCl2,过量则生成FeCl3 | |
| C. | 氯水滴入淀粉碘化钾稀溶液中,少量氯水有蓝色,过量蓝色消失 | |
| D. | NaClO溶液中通少量CO2生成Na2CO3和HClO,过量生成NaHCO3和HClO |
10. 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
完成下列填空:
(1)Cl2O是HClO 酸的酸酐,Cl2O电子式为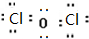 .
.
(2)下列能判断Cl和O两种元素非金属性强弱的是ac(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律.
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是2ClO2+2OH-=ClO2-+ClO3-+H2O,氧化产物ClO3-.(填离子符号)
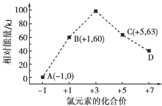
(5)一定条件下,在水溶液中1mol Cl-、ClO${\;}_{x}^{-}$(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是ClO4-(填离子符号).B→A+C的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 相对分子质量 | 87 | 67.5 | 183 |
| 沸点/℃ | 2 | 9.7 | 81 |
(1)Cl2O是HClO 酸的酸酐,Cl2O电子式为
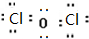 .
.(2)下列能判断Cl和O两种元素非金属性强弱的是ac(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律.
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是2ClO2+2OH-=ClO2-+ClO3-+H2O,氧化产物ClO3-.(填离子符号)
(5)一定条件下,在水溶液中1mol Cl-、ClO${\;}_{x}^{-}$(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是ClO4-(填离子符号).B→A+C的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
17.化学与生活密切相关,下列应用中利用了物质氧化性的是( )
| A. | 明矾净化水 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 双氧水消毒 |
14.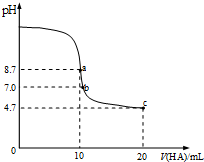 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA) | B. | a、c两点溶液中水的电离程度相同 | ||
| C. | b点溶液中:c(Na+)=c(A-)+c(HA) | D. | c点溶液中:c(A-)>c(HA) |
