��Ŀ����
5����A��B��C��D��E��F��G�������ʣ�A��CΪ�������ʣ�CΪ����ɫ���壬E��һ����������Ư�����ã�F��ˮ��Һ��һ��ǿ�ᣬG����ɫ��ӦΪ��ɫ������֮��Ĺ�ϵ��ͼ��ʾ����������������ȥ��
��ش��������⣺
��1��д���������ʵ����ƣ�A���ƣ�B��ˮ��D���������ƣ�
��2��B��C��Ӧ�Ļ�ѧ����ʽ��Cl2+H2O=HCl+HClO��1mol C��ȫ��Ӧ��ת�Ƶ���1mol��
��3��F��G��Ӧ�Ļ�ѧ����ʽ��HCl+NaClO=HClO+NaCl��
��4������F�������ӵķ�����������ȡ����F��Һ���Թ��У�����Һ���ȼ�����ϡ���ᣬȻ��μ���������Һ�����������ɫ��������˵�����������ӣ����������ӣ�
���� ��A��B��C��D��E��F��G�������ʣ�A��CΪ�������ʣ�CΪ����ɫ���壬��C��Cl2��E��һ����������Ư�����ã���E��HClO��F��һ��ǿ�ᣬCl2��H2O��Ӧ����HCl��HClO����������ǿ�ᣬ��BΪH2O��
G����ɫ��ӦΪ��ɫ����G�к���NaԪ�أ�A�ǵ��ʣ�����Ԫ���غ�֪��AΪNa��DΪNaOH��GΪNaClO��NaClO��HCl��Ӧ����HClO���ݴ˷������
��� �⣺��A��B��C��D��E��F��G�������ʣ�A��CΪ�������ʣ�CΪ����ɫ���壬��C��Cl2��E��һ����������Ư�����ã���E��HClO��F��һ��ǿ�ᣬCl2��H2O��Ӧ����HCl��HClO����������ǿ�ᣬ��BΪH2O��G����ɫ��ӦΪ��ɫ����G�к���NaԪ�أ�A�ǵ��ʣ�����Ԫ���غ�֪��AΪNa��DΪNaOH��GΪNaClO��NaClO��HCl��Ӧ����HClO��
��1��A��B��D���Ʒֱ����ơ�ˮ���������ƣ��ʴ�Ϊ���ƣ�ˮ���������ƣ�
��2��B��ˮ��C��������B��C��Ӧ�Ļ�ѧ����ʽ��Cl2+H2O=HCl+HClO���÷�Ӧ�������������������ǻ�ԭ����1mol C��ȫ��Ӧ��ת�Ƶ���1mol��
�ʴ�Ϊ��Cl2+H2O=HCl+HClO��1��
��3��F�����ᡢG�Ǵ������ƣ�F��G��Ӧ�Ļ�ѧ����ʽ��HCl+NaClO=HClO+NaCl���ʴ�Ϊ��HCl+NaClO=HClO+NaCl��
��4��F��HCl�������Ӽ��鷽���ǣ�ȡ����F��Һ���Թ��У�����Һ���ȼ�����ϡ���ᣬȻ��μ���������Һ�����������ɫ��������˵�����������ӣ����������ӣ��ʴ�Ϊ��ȡ����F��Һ���Թ��У�����Һ���ȼ�����ϡ���ᣬȻ��μ���������Һ�����������ɫ��������˵�����������ӣ����������ӣ�
���� ������ClԪ��Ϊ���忼�����ƶϣ�Ϊ��Ƶ���㣬��ȷ�������ʼ�����֮��ֻ���ǽⱾ��ؼ������ؿ���ѧ��֪ʶ�ۺ�Ӧ�����������������������ʼ����Ӽ��鷽����������Ŀ�ѶȲ���

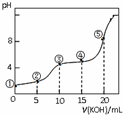 �����£���0.05mol•L-1 KOH��Һ�ζ� 10.00mL0.05mol•L-1 H2C2O4����Ԫ���ᣩ��Һ���õζ�������ͼ������仯���Բ��ƣ�������˵��������ǣ�������
�����£���0.05mol•L-1 KOH��Һ�ζ� 10.00mL0.05mol•L-1 H2C2O4����Ԫ���ᣩ��Һ���õζ�������ͼ������仯���Բ��ƣ�������˵��������ǣ�������| A�� | �����Һ�У�c��K+��+c��H+��=c��HC2O4-��+c��C2O42-��+c��OH-�� | |
| B�� | �����Һ�У�c��K+��=c��HC2O4-��+c��C2O42-��+c��H2C2O4�� | |
| C�� | �����Һ�У�c��K+��+c��H2C2O4��+c��HC2O4-��+c��C2O42-��=0.05 mol•L-1 | |
| D�� | �����Һ�У�c��K+����c��HC2O4-����c��C2O42-����c��OH-����c��H+�� |
��1����֪����2H2��g��+O2��g��=2H2O��l����H1=-571.6kJ•mol-1
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ•mol-1
��CO��g��+2H2��g��=CH3OH��g����H3=-90.8kJ•mol-1
���ʾCH3OH����ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH��g��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l������H=-763.8kJ•mol-1��
��2����һ���¶��£����±��е����ʵ���Ͷ���ݻ�Ϊ2L�ĺ����ܱ������У�������Ӧ��CO��g��+2H2��g��=CH3OH��g����H3=-90.8kJ•mol-1���õ��������ݣ�
| ʵ������ | �¶�/�� | ��ʼ��/mol | ƽ����/mol | ||||
| CO��g�� | H2��g�� | CH3OH��g�� | CH3OH��g�� | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
��750�棬�÷�Ӧ��ƽ�ⳣ��K=1.56��������λС����
����֪750��ʱ����ʵ��4������ɱ�ĺ�ѹ�ܱ������з�Ӧ���ﵽƽ��ʱCO���������ΪW%����ͬ�����£�����ʼʱ�����м���xmolCO��ymolH2��0.4molCH3OH���壬�ﵽƽ��ʱ��������CO�����������ΪW%����x��yӦ�����������x��y=1��2���ú�x��y��ʽ�ӱ�ʾ����
��3�����ü״�ͨ����ͼװ�õ�⾫��ͭ����ش��������⣺
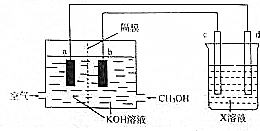
��Ӧѡ��ͭ��d�缫�ĵ缫���ϣ�C�缫������Ϊ������X��ҺΪ����ͭ��Һ��
��b�缫�ĵ缫��ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��
�۵�⾫��������a�缫������Һ��pH���������������С�����䡱��

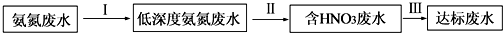
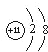 �����Ӻ�Ba��NO3��2��Ӧ���ɲ���������İ�ɫ������D��Ũ��Һ��KMnO4��ϣ����ɵ�������ʹʯ����Һ��ɫ��A��ˮ��Һ�����ԣ��û�ѧʽ��ʾA��B��C��D��E����ʲô���ʣ�д���йػ�ѧ����ʽ��
�����Ӻ�Ba��NO3��2��Ӧ���ɲ���������İ�ɫ������D��Ũ��Һ��KMnO4��ϣ����ɵ�������ʹʯ����Һ��ɫ��A��ˮ��Һ�����ԣ��û�ѧʽ��ʾA��B��C��D��E����ʲô���ʣ�д���йػ�ѧ����ʽ��