题目内容
10.常温下,下列溶液中各离子浓度关系正确的是( )| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
分析 A.根据碳酸钠溶液中的物料守恒判断;
B.氨水为弱碱,混合液中氨水过量,溶液呈碱性,则c(OH-)>c(H+);
C.反应后生成氯化铵,根据氯化铵溶液中的质子守恒分析;
D.溶液为中性,氢离子与氢氧根离子浓度相等,根据电荷守恒可得c(Na+)=c(CH3COO-).
解答 解:A.根据碳酸钠溶液中的物料守恒得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故A错误;
B.pH=12的氨水溶液与pH=2的盐酸等体积混合,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.等物质的量的氨水和盐酸混合后的溶液,溶质为氯化铵,根据质子守恒可得:c(H+)=c(OH-)+c(NH3•H2O),故C正确;
D.溶液与NaOH溶液相混合后,所得溶液呈中性,则c(OH-)=c(H+),结合电荷守恒可知:c(Na+)>c(CH3COO-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法.

练习册系列答案
相关题目
20.化学反应时,反应物的量不同,产物或现象可能会发生变化.下列正确的是( )
| A. | 硫在少量氧气中燃烧成SO2,过量能生成SO3 | |
| B. | 铁丝在少量氯气中燃烧生成FeCl2,过量则生成FeCl3 | |
| C. | 氯水滴入淀粉碘化钾稀溶液中,少量氯水有蓝色,过量蓝色消失 | |
| D. | NaClO溶液中通少量CO2生成Na2CO3和HClO,过量生成NaHCO3和HClO |
1.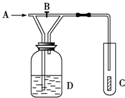 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
18.下列有机物中,所有的碳原子不可能都共面的是( )
| A. |  | B. |  | C. |  | D. |  |
2.明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)( )
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
19.下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
| A. | 黑火药爆炸 | B. | 用铁矿石炼铁 | C. | 湿法炼铜 | D. | 转轮排字 |
