题目内容
16.三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )| A. | 三种气体质量相等 | B. | 三种气体的物质的量之比为16:2:1 | ||
| C. | 三种气体压强比为16:2:1 | D. | 三种气体体积比为1:8:16 |
分析 A.容器的容积不确定,无法确定质量;
B.容器的容积不确定,无法确定物质的量;
C.根据PV=nRT=$\frac{m}{M}$RT可得PM=ρRT;
D.容器的容积不确定,无法确定气体体积.
解答 解:A.相同温度下,三种气体的密度相等,但容器体积未知,无法计算其质量,故A错误;
B.相同温度下,三种气体的密度相等,但容器体积未知,无法计算其质量,也无法计算其物质的量之比,故B错误;
C.根据PV=nRT=$\frac{m}{M}$RT可得PM=ρRT,氢气的摩尔质量是2g/mol,甲烷的摩尔质量是16g/mol、氧气的摩尔质量是32g/mol,气体的温度、密度都相等,所以其压强之比为16:2:1,故C正确;
D.容器的容积不确定,无法确定气体体积,故D错误;
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,灵活运用公式是解本题关键,注意PV=nRT理解阿伏伽德罗定律及其推论,题目难度不大.

练习册系列答案
相关题目
6.在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g)?3C(g),下列不能说明可逆反应达到平衡状态的是( )
| A. | B的浓度不再变化 | |
| B. | 混合气体的压强不再变化 | |
| C. | 混合气体的密度不再变化 | |
| D. | 混合气体的平均相对分子质量不再改变 |
7.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | Na2O2晶体中既含有离子键又含有共价键 |
4.在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
1.某溶液中有Cu2+、SO42-、Cl-、NO3-四种离子,若向溶液中加入足量的Ba(OH)2溶液,溶液中能大量减少的离子是( )
①Cu2+ ②SO42- ③Cl- ④NO3-.
①Cu2+ ②SO42- ③Cl- ④NO3-.
| A. | ① | B. | ② | C. | ①② | D. | ③④ |
8.下列叙述中正确的是( )
| A. | 含最高价元素的化合物,一定具有强氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子多的还原剂,还原性就强 | |
| D. | 化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原 |
5.相同浓度的下列溶液:①NH4Cl、②NH4HCO3、③NH4HSO4、④(NH4)2CO3中,c(NH4+)由大到小的顺序是( )
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ④>②>①>③ | D. | ④>②>③>① |
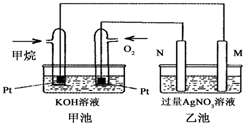 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题: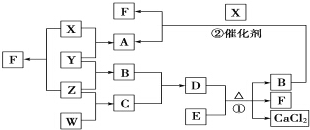 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.