题目内容
5.相同浓度的下列溶液:①NH4Cl、②NH4HCO3、③NH4HSO4、④(NH4)2CO3中,c(NH4+)由大到小的顺序是( )| A. | ④>③>②>① | B. | ④>③>①>② | C. | ④>②>①>③ | D. | ④>②>③>① |
分析 ①NH4Cl ②NH4HCO3③NH4HSO4 ④(NH4)2CO3中,先不考虑水解,则④(NH4)2SO4中含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,溶液中c(NH4+)根据盐类水解的影响分析判断.
解答 解:物质的量浓度相同的下列溶液:①NH4Cl ②NH4HCO3③NH4HSO4 ④(NH4)2CO3,先不考虑水解,则④(NH4)2CO3中含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,而①NH4Cl中铵根离子的水解既没被促进也没被抑制,②NH4HCO3中NH4+水解显酸性,HCO3-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,③NH4HSO4中氢离子对铵根离子的水解有抑制作用,铵根离子水解程度变小,即溶液中c(NH4+)③>①>②;
故按c(NH4+)由大到小的顺序排列为:④>③>①>②;
故选B.
点评 本题考查盐类水解的原理和应用,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,题目难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
15. 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.
(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
请完成下列问题.
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
16.三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )
| A. | 三种气体质量相等 | B. | 三种气体的物质的量之比为16:2:1 | ||
| C. | 三种气体压强比为16:2:1 | D. | 三种气体体积比为1:8:16 |
20.下列装置所迸行的实验不能达到目的是( )
| A. |  形成红色喷泉 | B. |  制取纯净、干燥的氯气 | ||
| C. |  探究原电池原理 | D. |  分离三氯甲烷和四氯化碳 |
10.某种不饱和烃分子中含有一个C≡C键、一个C═C键,催化加氢后的结构简式如下:(CH3CH2)2CHCH2CH(CH3)CH(CH3)2,则该烃的结构最多有( )
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 10种 |
17.在某温度下,pH相同的CH3COOH溶液(浓度为cmol/L)和NH4Cl溶液,溶液中水电离出的c(H+)分别是10-amol/L和10-bmol/L.在该条件下,下列说法正确的是( )
| A. | 两溶液中水的电离程度相同 | B. | 水的离子积常数为1.0×10-(a+b) | ||
| C. | CH3COOH的电离常数为$\frac{(1{0}^{-2a})}{c}$ | D. | 两溶液中c(CH3COO-)=c(NH4+) |
16.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:
根据上述实验,下列说法正确的是( )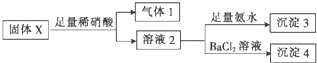
根据上述实验,下列说法正确的是( )

| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
17.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的NaOH | B. | 液态HCl | C. | KCl溶液 | D. | 蔗糖溶液 |