题目内容
4.在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2?2SO3,下列叙述正确的是( )| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
分析 A、因为该反应为可逆反应,平衡时是动态平衡,据此判断;
B、平衡时,如果SO3的浓度可能为0.2mol/L,则消耗二氧化硫是0.4mol;
C、化学平衡状态是动态平衡;
D、平衡常数是温度的函数.
解答 解:A、因为该反应为可逆反应,平衡时是动态平衡,所以在SO2中也会含有18O,故A错误;
B、平衡时,如果SO3的浓度可能为0.2mol/L,则消耗二氧化硫是0.4mol,平衡状态研究的对象是可逆反应,不可能完全转化,故B错误;
C、化学平衡状态是动态平衡,正逆反应正不停的进行,故C错误;
D、平衡常数是温度的函数,温度不变,所以改变SO2和O2的加入量,平衡常数不变,故D正确;
故选D.
点评 本题主要考查化学平衡的特征以及可逆反应在化学工工业生产的应用问题,中等难度,解题要注意化学平衡常数是温度的函数.

练习册系列答案
相关题目
14.在容量瓶的使用方法中,下列操作正确的是( )
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用水洗净后,在干燥箱中 干燥 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 | |
| D. | 定容后,盖好瓶塞,用食指顶住瓶塞,手握住瓶进颈,左右振荡摇匀 |
15. 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.
(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
请完成下列问题.
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
12.下列物质所属类别正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
16.三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )
| A. | 三种气体质量相等 | B. | 三种气体的物质的量之比为16:2:1 | ||
| C. | 三种气体压强比为16:2:1 | D. | 三种气体体积比为1:8:16 |
16.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:
根据上述实验,下列说法正确的是( )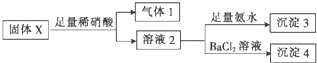
根据上述实验,下列说法正确的是( )

| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
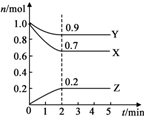 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.