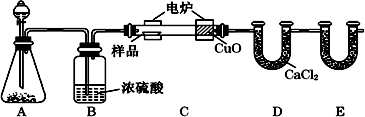
题目内容
16.煤气化和液化是现代能源工业中重点考虑的能源综合利用方案.最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH.已知制备甲醇的有关化学反应及平衡常数如下:①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
分析 (1)①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
依据盖斯定律计算①+②得到CO(g)+2H2(g)═CH3OH(g)△H 3;平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(2)CO(g)+2H2(g)═CH3OH(g)△H 3=-132.0 kJ/mol,反应是气体体积减小的放热反应,依据化学平衡影响因素和平衡移动原理分析判断选项;
(3)850℃平衡常数分别为k1=160,计算浓度商和平衡常数比较判断反应进行方向,
CO2(g)+3H2(g)═CH3OH(g)+H2 O(g),
起始量(mol/L) 0.6 1.4 0 0
变化量(mol/L) 0.4 1.2 0.4 0.4
10min量(mol/L)0.2 0.2 0.4 0.4
反应速率v=$\frac{△c}{△t}$;
(4)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答.
解答 解:(1)①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
依据盖斯定律计算①+②得到CO(g)+2H2(g)═CH3OH(g)△H 3=-132.0 kJ/mol,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)平衡常数K=$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$,
故答案为:-132.0 kJ/mol;$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$;
(2)CO(g)+2H2(g)═CH3OH(g)△H 3=-132.0 kJ/mol,反应是气体体积减小的放热反应,
A.反应前后气体体积变化,恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡,故A正确;
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,表明反应正向进行,不能说明可逆反应达到平衡,故B错误;
C.催化剂改变反应速率,不改变化学平衡,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,故C错误;
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L-1,则CO的转化率=$\frac{2mol-0.2mol/L×2L}{2mol}$×100%=80%,故D正确;
故答案为:AD;
(3)850℃平衡常数分别为k1=160,CO2(g)+3H2(g)═CH3OH(g)+H2 O(g),浓度商Qc=$\frac{0.4×0.4}{0.2×0.{2}^{3}}$=100<K=160,说明反应正向进行,v正>v逆 ,
CO2(g)+3H2(g)═CH3OH(g)+H2 O(g),
起始量(mol/L) 0.6 1.4 0 0
变化量(mol/L) 0.4 1.2 0.4 0.4
10min量(mol/L)0.2 0.2 0.4 0.4
该时间段内反应速率v(H2)=$\frac{1.2mol/L}{10min}$=0.12mol/(L•min),
故答案为:>;0.12mol/(L•min);
(4)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比较B相当于增大二氧化碳的量,转化率小于A,所以曲线 I代表A的投料,
故答案为:A.
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.5 1 0 0
变化浓度:0.21 0.63 0.21 0.21
平衡浓度:0.29 0.37 0.21 0.21
当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为,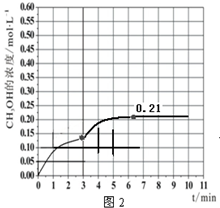
故答案为: ;
;
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,题目难度较大.

| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
| A. | Fe(OH)3→Fe2O3→Fe | B. | NH3→NO→NO2→HNO3 | C. | S→SO3→H2SO4 | D. | Cl2→HClO→NaClO |
| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
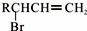 .
.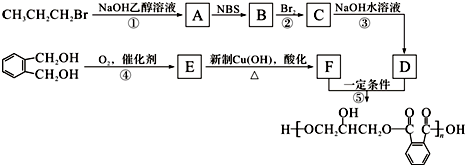
 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.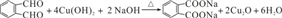 ;
;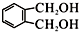 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.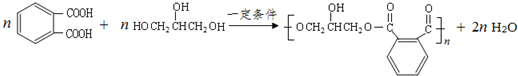 .
.