题目内容
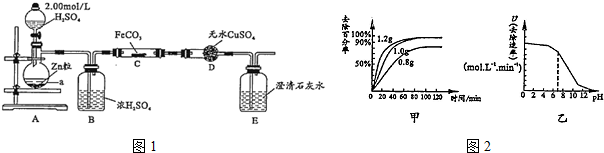
8.除化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.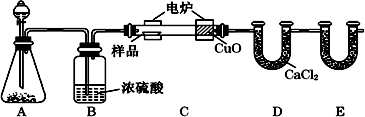
回答下列问题:
(1)A装置中分液漏斗盛放的物质是H2O2或(H2O),写出A中有关反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑
(2)C装置(燃烧管)中CuO的作用是把燃烧生成CO转化为CO2,使实验数据更准确
(3)实验开始时,要先通入氧气一会儿,然后再加热电炉,原因是排尽装置中的空气
(4)写出E装置中所盛放试剂的名称碱石灰(或固体NaOH),它的作用是吸收燃烧生成的CO2
(5)若将B装置去掉会对实验造成什么影响?将使测量数据中的氢元素含量增大.有同学认为应在E后再加一与E相同的装置F,目的是防止空气中的CO2和水蒸汽进入E装置,影响实验的准确性
(6)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为CH2O;,实验室通常通过质谱法测出该物质的相对分子质量为90,且该化合物能发生自身酯化反应,则其结构简式可能为CH3CHOHCOOH、CH2OHCH2COOH.
分析 用燃烧法测定有机物组成,A可用过氧化氢在二氧化锰催化作用下生成氧气(也可用过氧化钠和水),经B干燥后在C中与样品反应生成二氧化碳和水,C中CuO可将CO转化为二氧化碳,避免实验误差,D用于吸收水,E用于吸收二氧化碳,根据二氧化碳的质量可求C元素的质量,由水的质量可求得H元素的质量,结合有机物的质量可求出O元素的质量,由此即可确定有机物分子中C、H、O个数比,也就是确定了实验式,结合该有机物的相对分子质量可以确定有机物的分子式,以此解答该题.
解答 解:用燃烧法测定有机物组成,A可用过氧化氢在二氧化锰催化作用下生成氧气,经B干燥后在C中与样品反应生成二氧化碳和水,C中CuO可将CO转化为二氧化碳,避免实验误差,D用于吸收水,E用于吸收二氧化碳,根据二氧化碳的质量可求C元素的质量,由水的质量可求得H元素的质量,结合有机物的质量可求出O元素的质量,由此即可确定有机物分子中C、H、O个数比,也就是确定了实验式,结合该有机物的相对分子质量可以确定有机物的分子式,
(1)装置A是制备氧气的,所以根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑,故答案为:H2O2或(H2O);2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)由于有机物在燃烧过程中,有可能产生CO,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O,
故答案为:CO转化为CO2,使实验数据更准确;
(3)装内有空气,空气中的二氧化碳会导致实验误差,为排尽装置中的空气,应先通入氧气,故答案为:排尽装置中的空气;
(4)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠,
故答案为:碱石灰(或固体NaOH); 吸收燃烧生成的CO2;
(5)B装置的作用是干燥氧气,除去水蒸气,所以若将B装置去掉会造成测得有机物中含氢量增大,实验中,要避免空气中的水以及二氧化碳干扰试验,应该在E装置后接一个充满碱石灰的U形干燥管,
故答案为:将使测量数据中的氢元素含量增大;防止空气中的CO2和水蒸汽进入E装置,影响实验的准确性;
(6)E管质量增加1.76克说明生成了1.76克二氧化碳,可得碳元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g,
D管质量增加0.72克说明生成了0.72克水,可得氢元素的质量:0.72g×$\frac{2}{18}$×100%=0.08g,
从而可推出含氧元素的质量为:1.2-0.48-0.08=0.64g,
设最简式为CXHYOZ,
12X:Y:16Z=0.48::0.08:0.64
X:Y:Z=1:2:1,
最简式为 CH2O,
可用质谱测定有机物的相对分子质量,该物质的相对分子质量为90,则分子式为C3H6O3,且该化合物能发生自身酯化反应,说明有机物含有羟基、羧基,结构简式应为CH3CHOHCOOH、CH2OHCH2COOH,
故答案为:CH2O; 质谱; CH3CHOHCOOH、CH2OHCH2COOH.
点评 本题考查有机物组成的测定,试题综合性强,难易适中,贴近高考,主要是考查学生灵活运用基础知识解决实际问题的能力,有助于培养学生的逻辑推理能力和发散思维能力.要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
①石灰水 ②酸性KMnO4溶液 ③溴水 ④用硝酸酸化的Ba(NO3)2溶液 ⑤品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
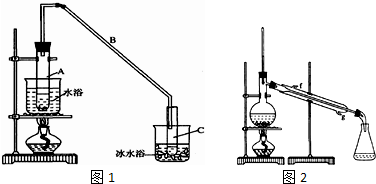
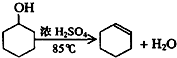
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A采用水浴加热的优点是均匀受热,容易控制反应温度.
②试管C置于冰水浴中的目的是试管C置于冰水浴中.
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c(填字母,单选)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填g或f).蒸馏时要加入生石灰,目的是生石灰吸收水分,便于蒸馏出更纯净的产品.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母,单选).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.