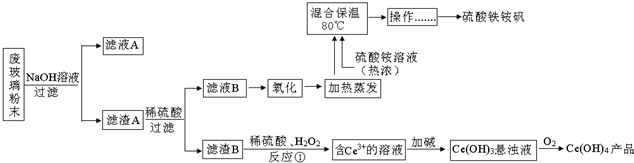
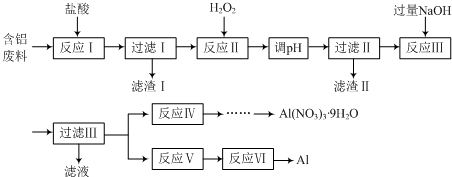
题目内容
8.下列说法中正确的是( )| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
分析 A.同素异形体是指同种元素组成的不同单质;
B.同系物是指结构相似,组成上相差CH2的物质互称同系物;
C.同位素是指质子数相同,中子数不同的同种元素的不同原子互为同系物;
D.分子式相同,结构不同的有机物互为同分异构体;
解答 解:A.同素异形体是指同种元素组成的不同单质,816O、817O、818O互为同位素,不是单质不是同素异形体,故A错误;
B.同系物是指结构相似,组成上相差CH2的物质互称同系物,正戊烷、异戊烷、新戊烷互为同分异构体,不是同系物,故B错误;
C.同位素是指质子数相同,中子数不同的同种元素的不同原子互为同位素,O2与O3互为同素异形体,故C错误;
D.分子式相同,结构不同的有机物互为同分异构体,CH3-CH2-OH与CH3-O-CH3互为同分异构体,故D正确;
故选D.
点评 本题考查了同素异形体、同位素、同系物、同分异构体等概念实质的理解应用,注意微粒的组成和概念的区别,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.下述实验不能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在碘水中加入约1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,再向试管里加入1mL浓KI水溶液,振荡试管,溶液紫色变浅 | 证明物质的溶解性规律--“相似相溶” |
| B | 取两只试管,分别加入4mL0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| C | 分别向2mL甲苯、2mL苯、2mL正己烷中加入3滴酸性高锰酸钾溶液,振荡.甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 将反应产生的气体依次通入盛有NaOH溶液、品红溶液及酸性KMnO4溶液的试管,品红不褪色,酸性KMnO4溶液褪色 | 证明乙醇与浓硫酸混合加热可得乙烯 |
| A. | A | B. | B | C. | C | D. | D |
16.煤气化和液化是现代能源工业中重点考虑的能源综合利用方案.最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH.已知制备甲醇的有关化学反应及平衡常数如下:
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
(4)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应①,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
20.已知草酸为二元弱酸:H2C2O4?HC2O4-+H+,Ka1;HC2O4-?C2O42-+H+,Ka2.常温下,向某浓度的草酸溶液中逐滴加入一定量的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )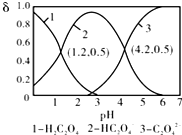

| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |