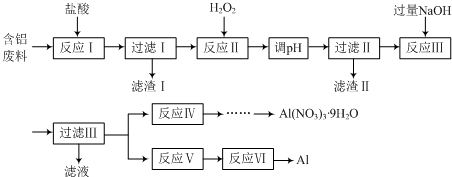
题目内容
7.研究铁及其化合物对于工业生产具有重要意义.(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)高铁酸钾(K2FeO4)是一种新型的水处理剂.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图1所示:
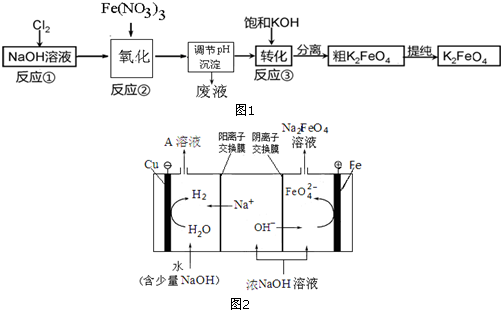
①反应②氧化过程所发生反应的离子方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,在生产中一般控制反应温度30℃以下,其原因是:防止生成的高铁酸钠发生分解.
②反应③中加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小.
③在提纯K2FeO4中采用重结晶、过滤、洗涤、低温烘干的方法,洗涤滤渣的方法是用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次_..
④若某温度下,将Cl2通入NaOH溶液中得到NaCl、NaClO、NaClO3的混合溶液,经测定溶液中ClO-与ClO3-的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为11:3.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为Fe+8OH--6e-=FeO42-+4H2O;其中可循环使用的物质是NaOH溶液.(填化学式)
分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(3)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次,
故答案为:用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:11:3;
(3)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.

| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为其分散质粒子直径在>1nm | |
| C. | 分子、原子、电子、质子、沙子中,沙子不适宜用物质的量描述,因为其是微观微粒 | |
| D. | 氧化铝是碱性氧化物,因为铝是金属元素 |
| 选项 | 实验内容 | 实验目的 |
| A | 在碘水中加入约1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,再向试管里加入1mL浓KI水溶液,振荡试管,溶液紫色变浅 | 证明物质的溶解性规律--“相似相溶” |
| B | 取两只试管,分别加入4mL0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| C | 分别向2mL甲苯、2mL苯、2mL正己烷中加入3滴酸性高锰酸钾溶液,振荡.甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 将反应产生的气体依次通入盛有NaOH溶液、品红溶液及酸性KMnO4溶液的试管,品红不褪色,酸性KMnO4溶液褪色 | 证明乙醇与浓硫酸混合加热可得乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)不相同.
(2)对实验3完成下列填空:
①石墨为正极,电极反应式:6H++6e-═3H2↑.
②电池总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极 (“负极”或“正极”),铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O,电池总反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.