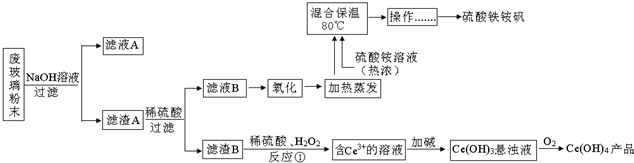
题目内容
11.草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸的工艺流程如图甲所示: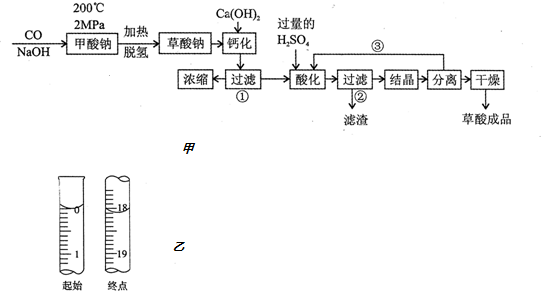
回答下列问题:
(1)该制备工艺中有两次过滤操作,过滤操作①的滤渣是CaC2O4;过滤操作②的滤液是H2C2O4溶液和H2SO4溶液.
(2)工艺过程③的目的是分别循环利用氢氧化钠和硫酸能降低成本,减小污染.工艺过程中还有一处与③的目的一样,其中涉及到的试剂是NaOH.
(3)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸.该方案的缺点是产品不纯,其中含有的杂质主要是Na2SO4.
(4)草酸成品的纯度用高锰酸钾滴定法测定.
①写出滴定反应的离子方程式5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
②称量草酸成品0.250g溶于水,用0.0500mol•L-1的酸性KMnO4溶液滴定,至浅粉色不消褪,滴定起始点和终点的液面位置如图乙,则消耗KMnO4溶液体积为18.10mL.计算该成品的纯度81.45%.
③下列操作会导致草酸成品的纯度的测定结果偏高的是bcd.
a.未干燥锥形瓶 b.滴定起始时滴定管尖嘴中产生气泡
c.滴定终点时仰视读数 d.滴定管未用标准溶液润洗.
分析 (1)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物;
(2)循环利用的物质能降低成本,减少污染;
(3)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)氢氧化钙和草酸钠溶液反应生成氢氧化钠和草酸钙,草酸钙难溶于水,所以过滤操作①的滤液是氢氧化钠溶液,滤渣是CaC2O4,草酸钙和稀硫酸反应生成草酸和硫酸钙,硫酸钙是微溶物,该操作过程中,稀硫酸过量,所以过滤操作②的滤液是H2C2O4溶液、H2SO4溶液,
故答案为:CaC2O4 ;H2C2O4溶液、H2SO4溶液;
(2)硫酸和氢氧化钠都具有腐蚀性,能污染环境,分别循环利用硫酸和氢氧化钠溶液,能降低成本,
故答案为:分别循环利用氢氧化钠和硫酸能降低成本,减小污染;NaOH;
(3)甲酸钠和硫酸反应生成硫酸钠,硫酸钠是可溶性物质,存在于溶液中,所以含有的杂质主要是Na2SO4,
故答案为:Na2SO4;
(4)①酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
②根据图中的数据,注意滴定管精确到0.01mL,读数为18.10mL,故消耗KMnO4溶液体积为18.10mL,设草酸的物质的量为xmol,则:
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1×0.018L
所以,5mol:2mol=x:0.0500mol•L-1×0.015L
解得x=0.00225mol,
故其纯度=$\frac{0.00225mol×126g/mol}{0.25g}$×100%=81.45%,
故答案为:81.45%;
③根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,当加入的标准液偏多,理论上草酸的浓度偏大,但实际上其纯度偏小,
a.未干燥锥形瓶,对溶质的物质的量无影响,不影响测定;
b.滴定起始时滴定管尖嘴中产生气泡,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,可知V(标准)偏大,c(待测)偏大;
c.滴定终点时仰视读数,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,将标准液读数度大,V(标准)偏大,c(待测)偏大;
d.滴定管未用标准溶液润洗,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$,表面上有水,加入的标准液偏多,可知V(标准)偏大,c(待测)偏大;
故选bcd.
点评 本题考查了化学与技术,明确操作时发生的化学反应、常见的操作名称,难点是计算草酸结晶水合物的纯度,根据方程式进行分析解答,难度中等.

| A. | 0.1mol | B. | 0.05mol | C. | 0.15mol | D. | 0.11mol |
 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有三种含氧官能团 | |
| B. | 可发生取代、加成及氧化反应 | |
| C. | 在水溶液中羟基和羧基均能电离出氢离子 | |
| D. | 与足量的钠反应在标况下能产生44.8L气体 |
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
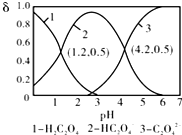
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| A. | c(CO32-)=0.01mol•L-1,c(NH4+)<c(SO42-) | |
| B. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ | |
| D. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |