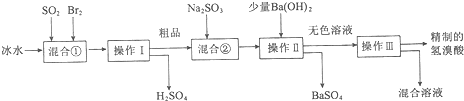
题目内容
5.已知:RCH2CH═CH2$\stackrel{NBS}{→}$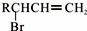 .
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
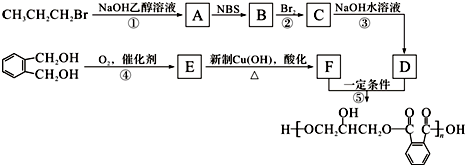
(1)B中含碳官能团的结构式为
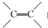 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.(2)反应①的有机反应类型是消去反应.
(3)下列说法正确的是b(填字母编号).
a.1molE与足量的银氨溶液反应能生成2molAg
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)写出E与新制的氢氧化铜悬浊液反应的化学方程式6
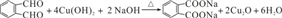 ;
;(5)
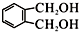 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)写出反应⑤的化学方程式
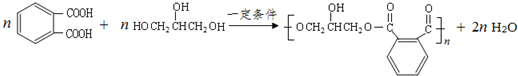 .
.
分析 由题中各物质的转化关系可知,CH3CH2CH2Br在氢氧化钠乙醇溶液中发生消去反应生成A为CH3CH=CH2,CH3CH=CH2在NBS作用之下发生取代反应生成B为BrCH2CH=CH2,BrCH2CH=CH2与Br2发生加成反应,生成C为BrCH2CHBrCH2Br,BrCH2CHBrCH2Br再碱性水解发生取代反应生成D为HOCH2CH(OH)CH2OH,根据 →E→F→
→E→F→ ,结合反应条件可知,E为
,结合反应条件可知,E为 ,F为
,F为 ,据此答题.
,据此答题.
解答 解:由题中各物质的转化关系可知,CH3CH2CH2Br在氢氧化钠乙醇溶液中发生消去反应生成A为CH3CH=CH2,CH3CH=CH2在NBS作用之下发生取代反应生成B为BrCH2CH=CH2,BrCH2CH=CH2与Br2发生加成反应,生成C为BrCH2CHBrCH2Br,BrCH2CHBrCH2Br再碱性水解发生取代反应生成D为HOCH2CH(OH)CH2OH,根据 →E→F→
→E→F→ ,结合反应条件可知,E为
,结合反应条件可知,E为 ,F为
,F为 ,
,
(1)根据上面的分析可知,B中含碳官能团的结构式为  ,C为BrCH2CHBrCH2Br,C的名称是1,2,3-三溴丙烷,
,C为BrCH2CHBrCH2Br,C的名称是1,2,3-三溴丙烷,
故答案为: ;1,2,3-三溴丙烷;
;1,2,3-三溴丙烷;
(2)根据上面的分析可知,反应①为消去反应,
故答案为:消去反应;
(3)a.E为 ,有两个醛基,所以1mol E与足量的银氨溶液反应能生成4molAg,故错误;
,有两个醛基,所以1mol E与足量的银氨溶液反应能生成4molAg,故错误;
b.F为 ,有两个羧基,能与NaHCO3反应产生CO2,故正确;
,有两个羧基,能与NaHCO3反应产生CO2,故正确;
c.检验CH3CH2CH2Br中的溴原子时,碱性水解后要把溶液调成酸性,再加硝酸银溶液,故错误,
故答案为:b;
(4)E与新制的氢氧化铜悬浊液反应的化学方程式为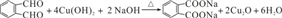 ,
,
故答案为: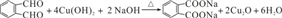 ;
;
(5) 的同分异构体中同时符合下列条件:a.能发生消去反应,b.能与过量浓溴水反应生成白色沉淀的芳香族化合物为
的同分异构体中同时符合下列条件:a.能发生消去反应,b.能与过量浓溴水反应生成白色沉淀的芳香族化合物为 ,以及这两种物质的基团在邻位和间位的化合物,共有6 种,
,以及这两种物质的基团在邻位和间位的化合物,共有6 种,
故答案为:6;
(6)反应⑤的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力与迁移运用能力,注意根据转化关系中的物质结构与反应条件进行推断,熟练掌握官能团的性质,难度中等.

①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
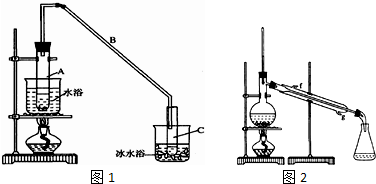
已知:
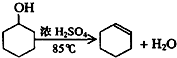
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A采用水浴加热的优点是均匀受热,容易控制反应温度.
②试管C置于冰水浴中的目的是试管C置于冰水浴中.
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c(填字母,单选)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填g或f).蒸馏时要加入生石灰,目的是生石灰吸收水分,便于蒸馏出更纯净的产品.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母,单选).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.