题目内容
6.一定温度下,在固定容积的密闭容器中发生反应:2HI═H2+I2,若c(HI)由0.1mol/L降到0.07mol/L需要15s,那么c(HI)由0.07mol/L降到0.06mol/L所需的反应时间为( )| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
分析 c(HI)由0.1mol/L降到0.07mol/L需要15s,则v(HI)=$\frac{0.1mol/L-0.07mol/L}{15s}$=0.002mol/(L.s),化学反应速率与反应物浓度成正比,反应物浓度越大其反应速率越快,随着反应进行反应物浓度降低,则其反应速率降低,据此分析解答.
解答 解:c(HI)由0.1mol/L降到0.07mol/L需要15s,则v(HI)=$\frac{0.1mol/L-0.07mol/L}{15s}$=0.002mol/(L.s),化学反应速率与反应物浓度成正比,反应物浓度越大其反应速率越快,随着反应进行反应物浓度降低,则其反应速率降低,c(HI)由0.07mol/L降到0.06mol/L如果反应速率为0.002mol/(L.s),则所需时间=$\frac{0.07mol/L-0.06mol/L}{0.002mol/(L.s)}$=5s,实际上反应速率小于0.002mol/(L.s),则所需时间大于5s,故选B.
点评 本题考查化学反应速率有关计算,为高频考点,明确物质浓度与反应速率关系是解本题关键,侧重考查学生分析计算能力,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.有关物质(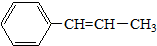 )的叙述正确的是( )
)的叙述正确的是( )
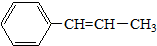 )的叙述正确的是( )
)的叙述正确的是( )| A. | 最多有5个碳原子在一条直线上 | |
| B. | 发生加聚反应的产物为: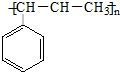 | |
| C. | 所有碳原子可能在同一平面上 | |
| D. | 1 mol该物质最多能与3 mol H2发生加成反应 |
17.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类及依据正确的是( )
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为其分散质粒子直径在>1nm | |
| C. | 分子、原子、电子、质子、沙子中,沙子不适宜用物质的量描述,因为其是微观微粒 | |
| D. | 氧化铝是碱性氧化物,因为铝是金属元素 |
14.设NA代表阿佛加德罗常数,下列说法正确的是( )
| A. | 常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA | |
| B. | 常温下,0.1mol•L-1NH4NO3溶液中,含有的氮原子数是0.2NA | |
| C. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| D. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA |
1.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.1mol | B. | 0.05mol | C. | 0.15mol | D. | 0.11mol |
11.配制一定物质的量浓度的KOH溶液时,造成实验结果偏高的原因是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的洗涤液未转入容量瓶中 | |
| C. | 往烧杯中转移溶液时有少量液体溅出 | |
| D. | 定容时俯视 |
18.下述实验不能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在碘水中加入约1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,再向试管里加入1mL浓KI水溶液,振荡试管,溶液紫色变浅 | 证明物质的溶解性规律--“相似相溶” |
| B | 取两只试管,分别加入4mL0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| C | 分别向2mL甲苯、2mL苯、2mL正己烷中加入3滴酸性高锰酸钾溶液,振荡.甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 将反应产生的气体依次通入盛有NaOH溶液、品红溶液及酸性KMnO4溶液的试管,品红不褪色,酸性KMnO4溶液褪色 | 证明乙醇与浓硫酸混合加热可得乙烯 |
| A. | A | B. | B | C. | C | D. | D |
16.煤气化和液化是现代能源工业中重点考虑的能源综合利用方案.最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH.已知制备甲醇的有关化学反应及平衡常数如下:
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
(4)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应①,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.