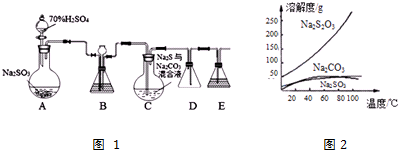
题目内容
1.我国的能源主要来源于燃煤,煤燃烧产生的烟气直接排放会引起严重的环境问题.将烟气通过石灰浆液的脱硫装置可以除去85%-90%的SO2,且最终会生产出几乎不含杂质的二氧化碳,减少碳排放.其装置如图所示.(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有BC(填字母)
A.光化学烟雾 B.酸雨 C.粉尘污染 D.水体富营养化
(2)石灰石浆液在进入脱硫装置前,需通入一段时间的二氧化碳,其目的是增大溶液中Ca2+的浓度,提高脱硫效率;脱硫时控制浆液的pH,此时浆液中含有的亚硫酸氢钙被足量氧气快速氧化成硫酸钙的化学方程式为Ca(HSO3)2+O2=CaSO4+H2SO4.
(3)下列措施中,有利于降低大气中CO2浓度的是BC(填字母).
A.增加化石燃料的使用 B.植树造林,增大植被面积
C.采用节能技术 D.大力发展火力发电
(4)将上述回收的CO2转化成有机物可有效实现碳循环.等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物,写出该反应的化学方程式CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH.上述反应的优点是原子利用率高,无副产物产生.
(5)已知某烟气中SO2的浓度为3.2×10-2g/L.若将处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,则该烟气中SO2的去除率为87.5%(假设脱硫得到的含硫化合物为CaSO4)
分析 (1)煤燃烧产生的烟气含二氧化硫及固体颗粒物;
(2)需通入一段时间的二氧化碳,提高钙离子浓度;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,产物只有一种;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol,以此计算该烟气中SO2的去除率.
解答 解:(1)煤燃烧产生的烟气含二氧化硫及固体颗粒物,二氧化硫可导致酸雨发生,固体颗粒导致粉尘污染,而光化学烟雾与N的氧化物排放有关,水体富营养化与N、P化合物排放有关,故答案为:BC;
(2)需通入一段时间的二氧化碳,其目的是增大溶液中Ca2+的浓度,提高脱硫效率;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸,反应为Ca(HSO3)2+O2=CaSO4+H2SO4,
故答案为:增大溶液中Ca2+的浓度,提高脱硫效率;Ca(HSO3)2+O2=CaSO4+H2SO4;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放,而植树造林,增大植被面积及采用节能技术均可降低大气中CO2浓度,
故答案为:BC;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,反应为CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH,该反应优点为原子利用率高,无副产物产生,
故答案为:CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH;原子利用率高,无副产物产生;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol=2.8×10-2g/L,该烟气中SO2的去除率为$\frac{2.8×1{0}^{-2}}{3.2×1{0}^{-2}}$×100%=87.5%,故答案为:87.5%.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境保护及化学反应的应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的洗涤液未转入容量瓶中 | |
| C. | 往烧杯中转移溶液时有少量液体溅出 | |
| D. | 定容时俯视 |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)不相同.
(2)对实验3完成下列填空:
①石墨为正极,电极反应式:6H++6e-═3H2↑.
②电池总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极 (“负极”或“正极”),铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O,电池总反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
①CO2(g)+3H2(g)═CH3OH(g)+H2 O(g)△H 1=-90.8KJ/mol,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H 2=-41.2kJ/mol,
③CO(g)+2H2(g)═CH3OH(g)△H 3
850℃平衡常数分别为k1=160,K2=243,K3=160,甲醇可以与乙酸反应制香料CH3OH(l)+CH3COOH(l)→CH3COOCH3(l)+H2O(l)
(1)则反应△H 3=-132.0 kJ/mol 制香料的K的表达式$\frac{c(C{H}_{3}COOC{H}_{3})c({H}_{2}O)}{c(C{H}_{3}OH)c(C{H}_{3}COOH)}$
(2)由CO合成甲醇时,以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2mol CO和6mol H2 充入2L密闭容器中,充分反应,达到平衡后,测得c (CO)=0.2mol•L- 1,则CO的转化率为80%
(3)850℃时,在密闭容器中进行反应①开始时只加入CO2、H2,反应10min后测得各组分的浓度如下比较正逆反应的速率的大小:v正>v逆(填“>、<或=”) 该时间段内反应速率v(H2)=0.12mol/(L•min)
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式A(用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线.
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
①石灰水 ②酸性KMnO4溶液 ③溴水 ④用硝酸酸化的Ba(NO3)2溶液 ⑤品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |