题目内容
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
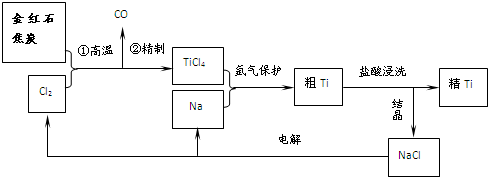
(1)写出金红石高温反应制取TiCl4的化学方程式 .
(2)写出电解熔融NaCl的化学方程式 ;阴极产物是 .
(3)粗钛产品粉碎后要用盐酸浸洗.其主要目的是 .
(4)Ti可溶解在浓HF溶液中,请完成下列离子方程式.
Ti+ HF- TiF62-+ ( )+ H2↑

(1)写出金红石高温反应制取TiCl4的化学方程式
(2)写出电解熔融NaCl的化学方程式
(3)粗钛产品粉碎后要用盐酸浸洗.其主要目的是
(4)Ti可溶解在浓HF溶液中,请完成下列离子方程式.
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)根据反应物和生成物结合质量守恒定律书写化学方程式;
(2)电解氯化钠生成金属钠和氯气,在阴极发生还原反应生成钠;
(3)从溶解平衡的角度分析;
(4)根据氧化还原反应得失电子数目相等和离子方程式电荷守恒的角度书写反应的离子方程式.
(2)电解氯化钠生成金属钠和氯气,在阴极发生还原反应生成钠;
(3)从溶解平衡的角度分析;
(4)根据氧化还原反应得失电子数目相等和离子方程式电荷守恒的角度书写反应的离子方程式.
解答:
解:(1)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
TiCl4+2CO,
故答案为:TiO2+2C+2Cl2
TiCl4+2CO;
(2)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
2Na+Cl2↑,在阴极发生还原反应生成钠,
故答案为:2NaCl (熔融)
2Na+Cl2↑;钠;
(3)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(4)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;H+;2.
| ||
故答案为:TiO2+2C+2Cl2
| ||
(2)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
| ||
故答案为:2NaCl (熔融)
| ||
(3)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(4)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;H+;2.
点评:本题考查物质的制备和分离的实验设计,题目难度中等,本题易错点为(3),注意从混合物的成分以及平衡移动的角度解答.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
某原子的最外层电子排布为nsnnp2n+1,则该元素在周期表中的位置为( )
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
下列有关原子核外电子排布的说法正确的是( )
| A、离核较近区域运动的电子能量较高 |
| B、M层最多容纳的电子数不超过8 |
| C、K层为最外电子层时最多只能容纳8个电子 |
| D、稀有气体元素的原子形成了稳定的电子层结构 |
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.