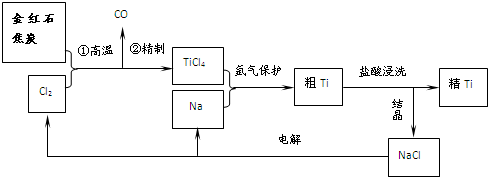
题目内容
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.(l)Cu的基态原子的核外电子排布式为
(2)Cu2O的熔点比Cu2S的高,其原因是
(3)CaC2是制备乙炔的原料,C22-与O22+互为等电子体,O22+的电子式可表示为
(4)AlCl3?NH3和AlCl4-中均含有配位键.在AlCl3?NH3中,提供空轨道的原子是
(5)铝晶体的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示.则铝晶体中原子的堆积方式是
考点:原子核外电子排布,共价键的形成及共价键的主要类型,配合物的成键情况,晶体熔沸点的比较,晶胞的计算
专题:化学键与晶体结构
分析:(1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)从影响离子晶体熔沸点高低的角度分析;
(3)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
(4)中心原子提供空轨道,通过计算Al价层电子对数求杂化类型;
(5)根据图乙可推算堆积方式为ABCABC…,可通过求每个晶胞的质量和体积计算密度.
(2)从影响离子晶体熔沸点高低的角度分析;
(3)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
(4)中心原子提供空轨道,通过计算Al价层电子对数求杂化类型;
(5)根据图乙可推算堆积方式为ABCABC…,可通过求每个晶胞的质量和体积计算密度.
解答:
解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高.
故答案为:Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高;
(3)根据等电子体的结构相似,O22+的电子式 ,在1个O22+含有2个π键,故答案为:
,在1个O22+含有2个π键,故答案为: ;2;
;2;
(4)AlCl3?NH3中Al为中心原子,NH3和Cl-为配体,中心原子提供空轨道,AlCl4-的价层电子对=4+
(3+1-4×1)=4,故Al采用sp3杂化,故答案为:Al;sp3;
(5)结合图乙和晶胞结构可知,金属铝中Al的堆积方式为ABCABCABC…,属于面心立方最密堆积,
铝原子半径为d cm,则晶胞的边上为2
dcm,晶胞的体积V=(2
dcm)3=16
d3cm3,一个晶胞含有Al原子个数为:8×
+6×
=4,一个晶胞的质量m=
×Mg,故密ρ=
=
g/cm3=
g/cm3,
故答案为:面心立方最密堆积;
g/cm3.
故答案为:1s22s22p63s23p63d104s1;
(2)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高.
故答案为:Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高;
(3)根据等电子体的结构相似,O22+的电子式
 ,在1个O22+含有2个π键,故答案为:
,在1个O22+含有2个π键,故答案为: ;2;
;2;(4)AlCl3?NH3中Al为中心原子,NH3和Cl-为配体,中心原子提供空轨道,AlCl4-的价层电子对=4+
| 1 |
| 2 |
(5)结合图乙和晶胞结构可知,金属铝中Al的堆积方式为ABCABCABC…,属于面心立方最密堆积,
铝原子半径为d cm,则晶胞的边上为2
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4 |
| NA |
| m |
| V |
| ||
16
|
| M | ||
4
|
故答案为:面心立方最密堆积;
| M | ||
4
|
点评:本题涉及的基态电子排布式、晶体熔沸点的比较较为简单,杂化类型的计算稍难,关于晶胞的密度等计算难度较大,需要细心根据密度公式求算.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
下列实验方案可行的是( )
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
根据下表所列电离能的数据,下列判断中错误的是.( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
下列分子中,原子的最外层电子不能都满足8电子稳定结构的是( )
| A、CO2 |
| B、Cl2 |
| C、H2O |
| D、PF3 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
下列有关实验的说法正确的是( )
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
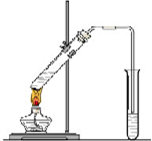 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题