题目内容
下列有关原子核外电子排布的说法正确的是( )
| A、离核较近区域运动的电子能量较高 |
| B、M层最多容纳的电子数不超过8 |
| C、K层为最外电子层时最多只能容纳8个电子 |
| D、稀有气体元素的原子形成了稳定的电子层结构 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A、离核较近区域运动的电子能量较低;
B、M层最多容纳的电子数不超过18个;
C、K层为最外电子层时最多只能容纳2个电子;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构.
B、M层最多容纳的电子数不超过18个;
C、K层为最外电子层时最多只能容纳2个电子;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构.
解答:
解:A、离核较近区域运动的电子能量较低,故A错误;
B、M层最多容纳的电子数不超过18个,故B错误;
C、K层为最外电子层时最多只能容纳2个电子,故C错误;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构,故D正确;
故选D.
B、M层最多容纳的电子数不超过18个,故B错误;
C、K层为最外电子层时最多只能容纳2个电子,故C错误;
D、稀有气体元素的原子最外层都达到了8个电子(He为2个电子)的稳定结构,故D正确;
故选D.
点评:本题考查了原子核外电子排布规律,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
| A、它的质子数一定是18 |
| B、它的原子和37Cl可能互为同位素 |
| C、它的单质一定是强还原剂 |
| D、可以确定该微粒为Ar |
以下四种溶液物质的量浓度均为0.01mol?L-1,下列说法正确的是( )
①NaHCO3②Na2CO3 ③CH3COOH ④CH3COONa.
①NaHCO3②Na2CO3 ③CH3COOH ④CH3COONa.
| A、①中各离子浓度为:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | ||||||
| D、③和④等体积混合后溶液的pH<7,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |

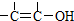 结构的物质不能稳定存在.
结构的物质不能稳定存在.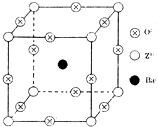 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.