题目内容
某原子的最外层电子排布为nsnnp2n+1,则该元素在周期表中的位置为( )
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
考点:原子核外电子排布,元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:该原子的最外层电子排布为nsnnp2n+1,np能级上排了电子,说明ns已经排满,电子数为2,即n=2,因此该原子的最外层电子排布为2s22p5,为F元素.
解答:
解:该原子的最外层电子排布为nsnnp2n+1,np能级上排了电子,说明ns已经排满,电子数为2,即n=2,因此该原子的最外层电子排布为2s22p5,为F元素,位于元素周期表的第二周期,ⅦA族,
故选B.
故选B.
点评:本题考查了原子核外电子排布规律,难度不大,根据核外电子排布规律判断出n的值为解题的关键.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
以下能级符号不正确的是( )
| A、6S | B、5p | C、4d | D、3f |
下列分子结构中,所有原子不能都满足最外层为8电子稳定结构的是( )
| A、CO2 |
| B、H2O |
| C、N2 |
| D、CCl4 |
 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
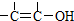 结构的物质不能稳定存在.
结构的物质不能稳定存在.