题目内容
6.某火力发电厂使用的燃料煤中硫的质量分数为0.32%.该电厂每天要燃烧这种煤200t,请通过计算回答:(1)如果煤中的硫全部转化为SO2,该电厂每天燃烧产生SO2多少升(标准状况)?
(2)将SO2用“钙基固硫法”处理可以“变废为宝”:SO2$\stackrel{CaO}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4
假设转化过程的损失可以忽略不计,计算该电厂每天用“钙基固硫法”处理产生的SO2,可获得纯度为85%的CaSO4多少吨?
分析 (1)求出煤炭中含有的硫的质量和物质的量,设硫燃烧时生成的二氧化硫的物质的量为xmol,根据方程式S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2计算;
(2)求出二氧化硫的物质的量,然后根据SO2$\stackrel{CaO}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4可知:SO2~CaSO4,设生成CaSO4的物质的量为ymol,据此可求出CaSO4的物质的量,然后根据=nM求出质量.
解答 解:(1)200t煤炭中含有的硫的质量m=200t×0.32%=0.64t=6.4×105g,物质的量n=$\frac{6.4g×1{0}^{5}g}{32g/mol}$=2×104mol,设硫燃烧时生成的二氧化硫的物质的量为xmol,根据方程式S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2可知:S+O2 $\frac{\underline{\;点燃\;}}{\;}$ SO2
1 1
2×104mol xmol
可得:$\frac{1}{2×1{0}^{4}mol}=\frac{1}{xmol}$
x=2×104mol
在标况下的体积V=nVm=2×104mol×22.4L/mol=4.48×105L.
答:该电厂每天燃烧产生SO24.48×105L;
(2)该电厂每天生成的二氧化硫的物质的量为2×104mol,而根据SO2$\stackrel{CaO}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4可知:SO2~CaSO4,设生成CaSO4的物质的量为ymol,故有:
SO2 ~CaSO4
1 1
2×104mol ymol
则有:$\frac{1}{2×1{0}^{4}mol}=\frac{1}{ymol}$
解得y=2×104mol
故所得的CaSO4的质量m=nM=2×104mol×136g/mol=2.72×106g=2.72t
可获得纯度为85%的CaSO4的质量m=$\frac{2.72t}{85%}$=3.2t.
答:可获得纯度为85%的CaSO4的质量为3.20t.
点评 本题考查化学方程式计算,注意利用守恒法计算,难度不大,旨在考查学生对基础知识的巩固.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
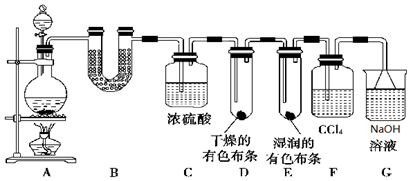
金牌教辅培优优选卷期末冲刺100分系列答案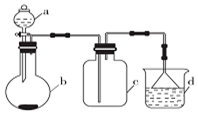 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
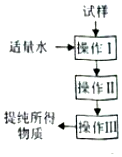 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1 mol乙烷在光照条件下最多能与3 mol Cl2发生取代反应 | |
| B. | 石油裂解气能使溴的四氯化碳溶液、酸性KMnO4溶液褪色 | |
| C. | 水煤气可用来合成液态烃、甲醇等有机物 | |
| D. | 苯可通过取代反应制得硝基苯、氯苯 |