题目内容
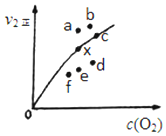
15.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略).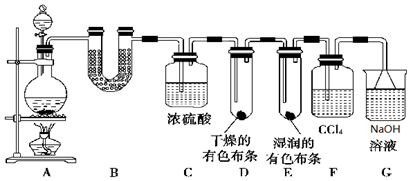
按要求回答下列问题.
(1)写出实验室制备Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)检查A装置气密性的方法关闭装置A中导气管,从分液漏斗加入水,若一段时间水不流下,证明气密性完好
(3)若用含有0.4mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于2.24L(标准状况)的原因是加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,反应停止
(4)①装置B中盛放的试剂名称为无水硫酸铜,现象是白色固体变蓝色.
②装置D和E中出现的不同现象说明的问题是氯气无漂白性,次氯酸有漂白性
③写出装置G中发生反应的离子方程式:H++OH-=H2O.
分析 装置A是制备氯气的发生装置,生成的氯气含水蒸气和氯化氢,通过装置B中硫酸铜检验生成水蒸气,通过装置C中浓硫酸吸收水蒸气,干燥氯气,通过干燥的有色布条,不褪色证明氯气无漂白性,通过装置E中湿润有色布条褪色,证明氯气和水反应生成的次氯酸具有漂白性,通过装置F中四氯化碳吸收氯气,最后剩余氯化氢被氢氧化钠溶液吸收,
(1)实验室常用浓盐酸和二氧化锰在加热的条件下制备氯气,据此写出反应的化学方程式;
(2)装置A烧瓶上导气管关闭,从分液漏斗加入水,若一段时间水不流下证明气密性完好;
(3)随着反应的进行,浓盐酸会变成稀加入盐酸,二氧化锰与浓盐酸反应,与稀盐酸不反应;
(4)①实验室常用无水硫酸铜检验水的存在,氯气易与碱反应,应用酸性干燥剂干燥;
②干燥氯气无漂白性,氯气与水反应生成次氯酸,具有漂白作用;
③生成的氯气中含有氯化氢,过程中不能除去氯化氢,最后通过氢氧化钠溶液吸收.
解答 解:(1)实验室常用浓盐酸和二氧化锰在加热的条件下制备氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)检查A装置气密性的方法是关闭装置A中导气管,从分液漏斗加入水,若一段时间水不流下,证明气密性完好,
故答案为:关闭装置A中导气管,从分液漏斗加入水,若一段时间水不流下,证明气密性完好;
(3)浓盐酸与足量MnO2反应制取Cl2,反应消耗氯化氢,同时反应需要加热,浓盐酸易挥发而损失,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,反应停止;
(4)①无水硫酸铜与水反应生成蓝色五水硫酸铜晶体,可用来检验水,
故答案为:无水硫酸铜;白色固体变为蓝色;
②干燥氯气无漂白性,氯气与水反应生成次氯酸,次氯酸具有漂白作用,
故答案为:氯气无漂白性,次氯酸有漂白性;
③装置F中氢氧化钠溶液可以吸收剩余氯化氢,防止倒吸,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O.
点评 本题考查性质实验方案的设计,题目难度中等,涉及了氯气的制备、氯气的性质、氯离子检验,明确实验的目的与原理是解题的关键,注意掌握氯气的化学性质及检验方法,试题侧重考查了学生的分析、理解能力及化学实验能力.

 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
(1)X的单质的电子式:
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
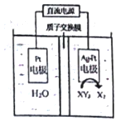
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
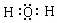 .
.(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
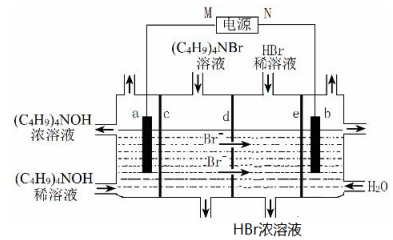
| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.
 .
. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应: